摘要:在锥形瓶中加入10mL2%硼酸.2滴混合指示剂.并吸取l0.0mL样品消化液从样品入口注入凯氏定氮仪.用10mL蒸馏水冲洗样品入口.再加10mL50%氢氧化钠溶液.打开水蒸汽发生器与反应器之间的夹子.蒸汽通入反应器使氨气全部被蒸发出来.并通过冷凝管而进入锥形瓶内.加热蒸气发生器5min.取下锥形瓶.
网址:http://m.1010jiajiao.com/timu_id_231812[举报]
 某同学设计如图装置制取少量溴苯,请回答下列问题:
某同学设计如图装置制取少量溴苯,请回答下列问题:(1)写出实验室制取溴苯的化学方程式:
C6H6+Br2
C6H5Br+HBr,
| FeBr3 |
C6H6+Br2
C6H5Br+HBr,
.| FeBr3 |
(2)上述反应发生后,在锥形瓶中加入硝酸银溶液观察到的现象是
淡黄色沉淀
淡黄色沉淀
,这一现象能否说明溴和苯发生了取代反应(填“能”或“不能”)不能
不能
,理由是挥发出来的溴进入锥形瓶与水反应生成的溴离子与硝酸银溶液发生反应,生成淡黄色沉淀
挥发出来的溴进入锥形瓶与水反应生成的溴离子与硝酸银溶液发生反应,生成淡黄色沉淀
.(3)反应后得到的溴苯中溶有少量苯、溴、三溴苯、溴化铁和溴化氢等杂质,欲除去上述杂质,得到无水溴苯的合理实验操作步骤可设计为(分液操作已略去):①水洗②碱洗③水洗④
B
B
⑤D
D
.(填序号,下同)(A) 分液 (B) 干燥 (C) 过滤 (D)蒸馏
(4)上述操作②碱洗的主要目的是
C
C
.A.除三溴苯和溴化氢 B.除溴化铁和三溴苯
C.除溴和溴化氢 D.除苯和溴.
为比较Fe2+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图1中甲、乙所示的实验.请回答下列问题:

(1)定性分析:如图甲可通过观察
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.图中仪器A的名称为
(3)某同学要利用乙装置测定某H2O2溶液的物质的量浓度.在锥形瓶中加入0.10mol MnO2粉末后加入50mL 该H2O2溶液,在标准状况下放出气体的体积和时间的关系如图2所示.
①写出H2O2在MnO2作用下发生反应的化学方程式
②实验中放出气体的总体积是
③A、B、C、D各点反应速率快慢的顺序为
④计算H2O2的初始的物质的量浓度
查看习题详情和答案>>

(1)定性分析:如图甲可通过观察
产生气泡的快慢
产生气泡的快慢
定性比较得出结论,有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是消除阴离子不同对实验的干扰
消除阴离子不同对实验的干扰
.(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.图中仪器A的名称为
分液漏斗
分液漏斗
,实验中需要测量的是产生40mL气体所需的时间
产生40mL气体所需的时间
.(3)某同学要利用乙装置测定某H2O2溶液的物质的量浓度.在锥形瓶中加入0.10mol MnO2粉末后加入50mL 该H2O2溶液,在标准状况下放出气体的体积和时间的关系如图2所示.
①写出H2O2在MnO2作用下发生反应的化学方程式
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;
| ||
②实验中放出气体的总体积是
60
60
mL;③A、B、C、D各点反应速率快慢的顺序为
D
D
>C
C
>B
B
>A
A
;④计算H2O2的初始的物质的量浓度
0.11mol/L
0.11mol/L
.(结果保留2位小数)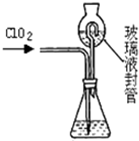 Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流.下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流.下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.ClO2是一种黄绿色的气体,易溶于水.实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
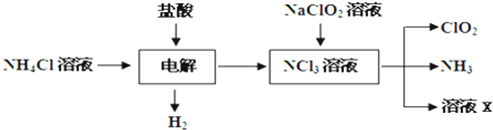
(1)写出电解时发生反应的化学方程式:
(2)除去ClO2中的NH3可选用的试剂是
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL足量硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收(假设吸收完全);将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液.
①装置中玻璃液封管的作用是
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式
③测得ClO2的质量m(ClO2)=
二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水.
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得.则该反应的氧化产物与还原产物的物质的量之比是
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如图1:
(2)写出电解时发生反应的化学方程式:
(3)除去ClO2中的NH3可选用的试剂是
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(4)测定ClO2(如图2)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液.
①装置中玻璃液封管的作用是
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式
③滴定终点的现象是:
④测得通入ClO2的质量m(ClO2)=
(5)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-.2001年我国卫生部规定,饮用水的ClO2-含量应不超过0.2mg/L.若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是
查看习题详情和答案>>
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得.则该反应的氧化产物与还原产物的物质的量之比是
1:2
1:2
.Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如图1:

(2)写出电解时发生反应的化学方程式:
NH4Cl+2HCl
3H2↑+NCl3
| ||
NH4Cl+2HCl
3H2↑+NCl3
;
| ||
(3)除去ClO2中的NH3可选用的试剂是
C
C
;(填序号)A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(4)测定ClO2(如图2)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液.
①装置中玻璃液封管的作用是
用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等
用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等
;②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式
2ClO2+10I-+8H+=2Cl-+5I2+4H2O
2ClO2+10I-+8H+=2Cl-+5I2+4H2O
;③滴定终点的现象是:
溶液由蓝色恰好变为无色,且半分钟内不褪色
溶液由蓝色恰好变为无色,且半分钟内不褪色
.④测得通入ClO2的质量m(ClO2)=
1.35cv×10-2g
1.35cv×10-2g
.(用含c、V的代数式表示)(5)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-.2001年我国卫生部规定,饮用水的ClO2-含量应不超过0.2mg/L.若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是
Fe(OH)3
Fe(OH)3
.(填化学式).二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.ClO2是一种黄绿色的气体,易溶于水.实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:

(1)写出电解时发生反应的化学方程式:
(2)除去ClO2中的NH3可选用的试剂是
A.碳酸钠溶液 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液.

①ClO2通入锥形瓶与酸性碘化钾溶液反应(还原产物为Cl-),反应的离子方程式为:
②装置中玻璃液封管的作用是
③滴定至终点的现象是
④测得ClO2的质量m(ClO2)
(4)设计实验来确定溶液X的成份,请补充完成实验步骤和现象.
查看习题详情和答案>>

(1)写出电解时发生反应的化学方程式:
NH4Cl+2HCl═3H2↑+NCl3
NH4Cl+2HCl═3H2↑+NCl3
.(2)除去ClO2中的NH3可选用的试剂是
C
C
.(填序号)A.碳酸钠溶液 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液.

①ClO2通入锥形瓶与酸性碘化钾溶液反应(还原产物为Cl-),反应的离子方程式为:
2ClO2+10I-+8H+=2Cl-+5I2+4H2O
2ClO2+10I-+8H+=2Cl-+5I2+4H2O
.②装置中玻璃液封管的作用是
用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等
用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等
.③滴定至终点的现象是
溶液由蓝色恰好变为无色,且半分钟内不褪色
溶液由蓝色恰好变为无色,且半分钟内不褪色
.④测得ClO2的质量m(ClO2)
1.35cv×10-2g
1.35cv×10-2g
.(用含c、V的代数式表示)(4)设计实验来确定溶液X的成份,请补充完成实验步骤和现象.
| 实验步骤 | 实验现象 | 实验结论 |
| ① 取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 |
火焰呈黄色 火焰呈黄色 |
溶液X中含有钠离子 |
| ② 取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液) 取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液) |
产生白色沉淀 产生白色沉淀 |
溶液X中含有氯离子 |