摘要:练习:.注意习题层次性.并适当设计开放性试题.为学生的开放性思维创造空间.培养学生能力.
网址:http://m.1010jiajiao.com/timu_id_21604[举报]
1.B 2.B 3.C
4.燃烧时放出的热量高且产物是水,不污染环境
5.氢气 水是由氢氧两种元素组成的,是一种化合物
6.(1)检查装置的气密性 (2)都用排水法收集
7.Zn+H2SO4=ZnSO4+H2↑
Mg+H2SO4=MgSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
镁的反应速度太快且镁的成本高;铁的成本虽低但反应速度太慢.
8.因为铁与稀硫酸反应会产生氢气,明火易引燃氢气与空气的混合气体发生爆炸
过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,同学们将包有Na2O2固体的棉花放入了如图1所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来.
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳具有
(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需满足
【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】
1.在常温下Na2O2与CO2、H2O均能发生化学反应.
2.无水硫酸铜为白色固体,吸水后变为蓝色.
【实验设计】经过讨论,同学们设计用如图2所示装置进行实验探究.
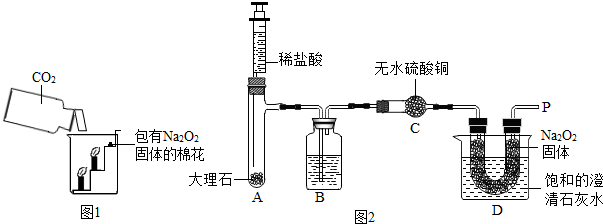
【实验步骤】
①检查整套装置的气密性;
②把相关的试剂放入对应的仪器内;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放置一根带火星的木条,观察现象.
注意:大理石与稀盐酸制取的CO2还会含有一定量的水蒸气,但整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响.
【实验现象】
①带火星的木条复燃; ②无水硫酸铜没有变蓝色; ③饱和的澄清石灰水变浑浊.
【实验分析】①B装置内盛放的试剂是
【实验结论】①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件.
②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件.
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为甲同学的猜想是错误的,理由是
②写出Na2O2和CO2反应的化学方程式
【定量探究】有一包久置的过氧化钠粉末,现已证明因其保存不当导致完全变质成为NaOH和Na2CO3的混合物,同学们称取了13.25g样品,加入足量稀盐酸,并将产生的气体通入足量的澄清石灰水中,得到白色沉淀,经过滤、洗涤、烘干后称得其质量为10g,试计算:样品中Na2CO3的质量分数.
查看习题详情和答案>>
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳具有
CO2密度比空气大,CO2不能燃烧也不支持燃烧
CO2密度比空气大,CO2不能燃烧也不支持燃烧
的性质.(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需满足
与氧气接触
与氧气接触
、温度达到着火点
温度达到着火点
.【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】
1.在常温下Na2O2与CO2、H2O均能发生化学反应.
2.无水硫酸铜为白色固体,吸水后变为蓝色.
【实验设计】经过讨论,同学们设计用如图2所示装置进行实验探究.

【实验步骤】
①检查整套装置的气密性;
②把相关的试剂放入对应的仪器内;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放置一根带火星的木条,观察现象.
注意:大理石与稀盐酸制取的CO2还会含有一定量的水蒸气,但整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响.
【实验现象】
①带火星的木条复燃; ②无水硫酸铜没有变蓝色; ③饱和的澄清石灰水变浑浊.
【实验分析】①B装置内盛放的试剂是
浓硫酸
浓硫酸
;②D装置烧杯内澄清石灰水变浑浊的原因可能是Na2O2和CO2反应放出热量,使石灰水温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体
Na2O2和CO2反应放出热量,使石灰水温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体
,也可能是空气中的CO2与澄清石灰水反应生成了难溶物使澄清石灰水变混浊.【实验结论】①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件.
②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件.
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为甲同学的猜想是错误的,理由是
反应前后元素种类不变,反应物中没有氢元素所以不能生成NaOH
反应前后元素种类不变,反应物中没有氢元素所以不能生成NaOH
.②写出Na2O2和CO2反应的化学方程式
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
.【定量探究】有一包久置的过氧化钠粉末,现已证明因其保存不当导致完全变质成为NaOH和Na2CO3的混合物,同学们称取了13.25g样品,加入足量稀盐酸,并将产生的气体通入足量的澄清石灰水中,得到白色沉淀,经过滤、洗涤、烘干后称得其质量为10g,试计算:样品中Na2CO3的质量分数.
现有Na、H、O、S四种元素,从中选择适当的元素按要求填空:
(1)用数字和符号表示:
①2个硫原子
(2)写出符合下列条件的化学方程式:
①分解反应
查看习题详情和答案>>
(1)用数字和符号表示:
①2个硫原子
2S
2S
; ②3个氢分子3H2
3H2
; ③2个硫酸根离子2SO42-
2SO42-
.(2)写出符合下列条件的化学方程式:
①分解反应
2H2O
2H2↑+O2↑
| ||
2H2O
2H2↑+O2↑
; ②中和反应
| ||
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+2NaOH=Na2SO4+2H2O
.用元素符号或化学式填空:
①氩元素 ; ②4个二氧化硫分子 ;
③氮气 ; ④7个银原子 ;
⑤3个氮原子 ; ⑥3个水分子 ;
⑦4个氢气分子 ; ⑧2个二氧化碳分子 ;
⑨氢的原子结构示意图 ; ⑩镁的原子结构示意图 .
查看习题详情和答案>>
①氩元素
③氮气
⑤3个氮原子
⑦4个氢气分子
⑨氢的原子结构示意图
某品牌矿泉水的标签上标明的矿泉水主要成分如下表所示,请根据本表回答下列问题
(1)硫酸根离子的化学符号是
(2)该矿泉水是
(3)该标签中涉及到的元素有
(4)每一瓶该矿泉水中质量最大的物质的化学式是
(5)为了判断得到的矿泉水是硬水或软水,可加入
(6)利用吸附,沉淀,过滤和蒸馏的方法可以使水净化,其中能降低水的硬度的
查看习题详情和答案>>
| 水质主要成分(mg/L) | |
| 偏硅酸(H2SiO3) 28.9-42.9 碳酸氢根 173-205 氯离子 1.0-8.0 镁 2.5-7.5 |
钙 5-45 钠 45-70 钾 0.5-2.0 pH 7.8±0.5 |
SO42-
SO42-
,钙离子的化学符号是Ca2+
Ca2+
.(2)该矿泉水是
混合物
混合物
(填“纯净物”或“混合物”或“化合物”).(3)该标签中涉及到的元素有
11
11
种.(4)每一瓶该矿泉水中质量最大的物质的化学式是
H2O
H2O
.(5)为了判断得到的矿泉水是硬水或软水,可加入
肥皂水
肥皂水
进行检验.(6)利用吸附,沉淀,过滤和蒸馏的方法可以使水净化,其中能降低水的硬度的
蒸馏
蒸馏
.