网址:http://m.1010jiajiao.com/timu_id_212946[举报]
1D
26.(1) H;
(2)2Mg + CO2 = 2MgO + C
(3)Na2CO3
(4)H
27.(1)CaC2+2H2O→Ca(OH)2+C2H2↑, 
(2)4
(3)棕黄色溶液变无色或褪色; 4.8
(4)合成氨原料,作燃料或有机化工原料(其他合理答案均给分)
28.(每空2分,共16分)
(1) 
(2)4Fe + 3 O2 +2 x H2O === 2 Fe2O3•x H2O
(3)2 FeCl3 + Fe == 3 FeCl2
(4)B D
(5)① 铜 Cu2+ + 2e- == Cu
② 0.08 mol
③ 铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀。(其他答案合理也给分)
29.(1)(4分)第三周期,第IA族; 
(2)(2分)2 NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(3)(6分)ClO―+ H2O  HClO +OH―
HClO +OH―
I、ClO―+Cl―+2H+ =Cl2↑+ H2O II、在a、b装置之间加一盛有饱和食盐水(或水)的洗气瓶,除去HCl
(4)(3分)3 mol ≤n(e―)≤5 mol
30.(
(2) n平(NH3)= ×25%=32 mol×25%=8 mol
×25%=32 mol×25%=8 mol
(2) 5∶4
(3) 2∶3
(4) 1∶2
(5) 3∶3∶2
已知:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①5 min内,消耗N2的平均反应速率为_______________,此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正_______________v(N2)逆(填写“>”、“=”或“<”=)。
②下列各项能作为判断该反应达到化学平衡状态的依据是__________(填序号字母)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
| N2 | H2 | NH3 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
请回答:
①各物质的平衡浓度可能是_______________.
A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a的取值范围是:_______________.
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。
(Ⅱ)a、b、c的关系:_______________。
(3) 根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l) ![]() 4NH3(g)+3O2(g),此反应的△S__________0(填“
4NH3(g)+3O2(g),此反应的△S__________0(填“![]() ”、 “
”、 “![]() ”或“=”), △H=_____________。
”或“=”), △H=_____________。
(已知:H2的燃烧热为285.8 kJ/mol)
查看习题详情和答案>>已知:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①5 min内,消耗N2的平均反应速率为_______________,此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正_______________v(N2)逆(填写“>”、“=”或“<”=)。
②下列各项能作为判断该反应达到化学平衡状态的依据是__________(填序号字母)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
|
| N2 | H2 | NH3 |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
请回答:
①各物质的平衡浓度可能是_______________.
A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a的取值范围是:_______________.
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。
(Ⅱ)a、b、c的关系:_______________。
(3) 根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l) 4NH3(g)+3O2(g),此反应的△S__________0(填“
”、 “
”或“=”), △H=_____________。
(已知:H2的燃烧热为285.8 kJ/mol)
查看习题详情和答案>>
已知:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/mol·L—1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
①5 min内,消耗N2的平均反应速率为_______________,此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正_______________v(N2)逆(填写“>”、“=”或“<”=)。
②下列各项能作为判断该反应达到化学平衡状态的依据是__________(填序号字母)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
|
|
N2 |
H2 |
NH3 |
|
起始浓度(mol/L) |
0.2 |
0.3 |
0.2 |
|
平衡浓度(mol/L) |
a |
b |
c |
请回答:
①各物质的平衡浓度可能是_______________.
A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a的取值范围是:_______________.
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。
(Ⅱ)a、b、c的关系:_______________。
(3) 根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l)  4NH3(g)+3O2(g),此反应的△S__________0(填“
4NH3(g)+3O2(g),此反应的△S__________0(填“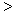 ”、 “
”、 “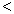 ”或“=”), △H=_____________。
”或“=”), △H=_____________。
(已知:H2的燃烧热为285.8 kJ/mol)
查看习题详情和答案>>
工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。 查看习题详情和答案>>
已知:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正_______________v(N2)逆(填写“>”、“=”或“<”=)。
②若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
| N2 | H2 | NH3 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
请回答:
①a的取值范围是:_______________.
②请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。(Ⅱ)a、b、c的关系:_______________。
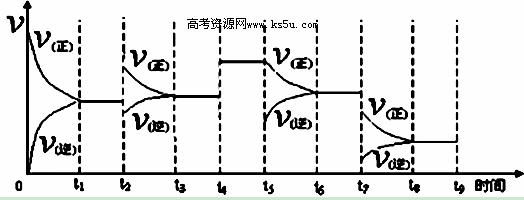
③反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2﹑t7时刻所对应的实验条件改变分别是:t2 ;t7 。