摘要:()
网址:http://m.1010jiajiao.com/timu_id_204491[举报]
(Ⅰ) 如图1,根据下面合成路线完成有关问题:
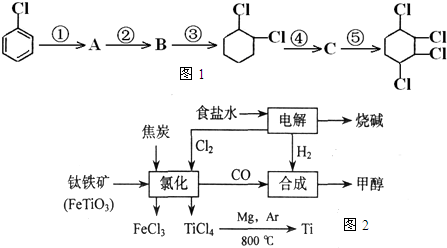
(1)写出B结构简式:B: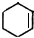
 ;
;
(2)第④步反应类型:
(3)A→B的反应试剂及条件:
(Ⅱ) 某烃相对分子质量为106,试求:
(1)该烃的分子式为
(2)该烃如含苯环,则在苯环上的一硝基取代物共有
(Ⅲ) 钛(Ti)被称为继铁、铝之后的第三金属,四川攀枝花和西昌地区的钒钛磁铁矿储量十分丰富.如图2所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.(钛铁矿中铁元素的化合价为+3价)
请填写下列空白:
(1)电解食盐水时,总反应的离子方程式是
(2)写出合成甲醇的化学方程式
(3)写出钛铁矿经氯化法得到四氯化钛的化学方程式:
查看习题详情和答案>>

(1)写出B结构简式:B:


(2)第④步反应类型:
消去反应
消去反应
;(3)A→B的反应试剂及条件:
NaOH/KOH醇溶液,加热
NaOH/KOH醇溶液,加热
;(Ⅱ) 某烃相对分子质量为106,试求:
(1)该烃的分子式为
C8H10
C8H10
.(2)该烃如含苯环,则在苯环上的一硝基取代物共有
9
9
种.(Ⅲ) 钛(Ti)被称为继铁、铝之后的第三金属,四川攀枝花和西昌地区的钒钛磁铁矿储量十分丰富.如图2所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.(钛铁矿中铁元素的化合价为+3价)
请填写下列空白:
(1)电解食盐水时,总反应的离子方程式是
2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
;
| ||
(2)写出合成甲醇的化学方程式
CO+2H2
CH3OH
| ||
CO+2H2
CH3OH
;
| ||
(3)写出钛铁矿经氯化法得到四氯化钛的化学方程式:
2FeTiO3 +6C+7Cl2
2TiCl4 +2FeCl3+6CO
| ||
2FeTiO3 +6C+7Cl2
2TiCl4 +2FeCl3+6CO
.
| ||
(Ⅰ)请根据官能团的不同对下列有机物进行分类. 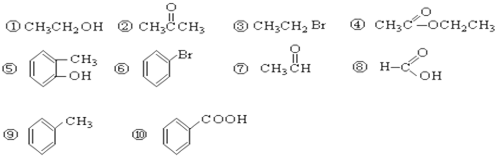
(1)芳香烃:
(Ⅱ)(1)键线式 表示的分子式
表示的分子式
(2) 中含有的官能团的名称为
中含有的官能团的名称为
(3)书写该物质的结构简式:2,6-二甲基-4-乙基辛烷:
(4)书写该物质的名称:
查看习题详情和答案>>

(1)芳香烃:
⑨
⑨
;(2)卤代烃:③⑥
③⑥
;(3)醇:①
①
; (4)酚:⑤
⑤
;(5)醛:⑦
⑦
;(6)酮:②
②
;(7)羧酸:⑧⑩
⑧⑩
;(8)酯:④
④
.(Ⅱ)(1)键线式
 表示的分子式
表示的分子式C6H14
C6H14
;名称是2-甲基-戊烷
2-甲基-戊烷
.(2)
 中含有的官能团的名称为
中含有的官能团的名称为酚羟基、酯基
酚羟基、酯基
.(3)书写该物质的结构简式:2,6-二甲基-4-乙基辛烷:
CH3CH(CH3)CH2CH(CH2CH3)CH2CH(CH3)CH2CH3
CH3CH(CH3)CH2CH(CH2CH3)CH2CH(CH3)CH2CH3
(4)书写该物质的名称:

3-甲基-1-戊烯
3-甲基-1-戊烯
. (Ⅰ)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)
(Ⅰ)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)A>C>B
A>C>B
.(Ⅱ)据报道,全世界每年因金属腐蚀造成的直接经济损失约达7000亿美元,我国因金属腐蚀造成的损失占国民生产总值(GNP)的4%.
(1)请你根据不同原理,提出防止钢铁锈蚀的两条合理措施:
①
改变金属内部结构(制成不锈钢)
改变金属内部结构(制成不锈钢)
;②刷漆(涂油、表面镀金属)
刷漆(涂油、表面镀金属)
.(2)请写出用稀硫酸除去铁锈的化学反应方程式:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
.(3)向含有铬离子(Cr3+)的废水中加入石灰乳[Ca(OH)2],降低溶液的酸度.当调节废水的PH至8~9时,铬离子形成Cr(OH)3沉淀而分离,其反应的离子方程式是:
2Cr3++3Ca(OH)2=2Cr(OH)3+3Ca2+
2Cr3++3Ca(OH)2=2Cr(OH)3+3Ca2+
. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:(1)用化学符号表示下列4种微粒:
A
H2O
H2O
;BNH3
NH3
;CNH4+
NH4+
;DOH-
OH-
.(2)写出A、B、E三种微粒反应的离子方程式:
Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+
Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+
.(Ⅱ)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
请回答下列问题:
(1)D的化学式是
NH3
NH3
,E的化学式是NH4Cl
NH4Cl
.(2)A和B反应生成C的化学方程式是:
H2+Cl2
2HCl
| ||
H2+Cl2
2HCl
.
| ||
(3)E和F反应生成D、H和G的化学方程式是:
2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2
| ||
2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2
.
| ||
(Ⅰ)常温下将体积为v1、浓度为c1的一元酸HA与体积为v2、浓度为c2的一元碱MOH混合.(1)若v1?c1=v2?c2,混合后的溶液pH>7,则一元弱酸的电离程度
(2)若v1=v2,一元弱碱的电离程度大于一元弱酸的电离程度,且混合后溶液pH<7,则c1
(Ⅱ)现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与0.01mol/L的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液.
(1)其中水的电离程度最大的是
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②
(3)将六份溶液稀释相同倍数后(不考虑极度稀释),溶液的pH:①
(4)将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈
A.酸性 B.碱性 C.中性.
查看习题详情和答案>>
<
<
(选填“>”、“<”或“=”)一元弱碱的电离程度;(2)若v1=v2,一元弱碱的电离程度大于一元弱酸的电离程度,且混合后溶液pH<7,则c1
>
>
c2(Ⅱ)现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与0.01mol/L的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液.
(1)其中水的电离程度最大的是
⑤
⑤
(选填序号,下同),水的电离程度相同的是②③④
②③④
;(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②
>
>
③(选填“>”、“<”或“=”);(3)将六份溶液稀释相同倍数后(不考虑极度稀释),溶液的pH:①
>
>
②,③>
>
④,⑤=
=
⑥(选填“>”、“<”或“=”);(4)将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈
ABC
ABC
.A.酸性 B.碱性 C.中性.