摘要:(5) 气体颜色变浅 . 烧瓶拿出后.气体温度降低.平衡2NO2N2O4,△H<0向右移动.NO2的浓度减小.气体颜色变浅. (6) a/4 mol< n < a/2 mol
网址:http://m.1010jiajiao.com/timu_id_204196[举报]
[s1] 一定条件下,在一容积固定的密闭容器中充入2molNO和1molO2,发生反应:
 2NO+O2===2NO2、2NO2 N2O4。下列推测中,正确的是 (
)
2NO+O2===2NO2、2NO2 N2O4。下列推测中,正确的是 (
)
A.平衡时体系中含NO、O2、NO2、N2O4
B.平衡后容器中压强为开始时的2/3
C.达到平衡后,压缩容器容积,混合气体颜色变浅
D.达到平衡后,再充入少量O2混合气体颜色不变
[s1]14.
查看习题详情和答案>>[s1] 一定条件下,在一容积固定的密闭容器中充入2molNO和1molO2,发生反应:
 2NO+O2===2NO2、2NO2 N2O4。下列推测中,正确的是 ( )
2NO+O2===2NO2、2NO2 N2O4。下列推测中,正确的是 ( )
A.平衡时体系中含NO、O2、NO2、N2O4
B.平衡后容器中压强为开始时的2/3
C.达到平衡后,压缩容器容积,混合气体颜色变浅
D.达到平衡后,再充入少量O2混合气体颜色不变
[s1]14.
查看习题详情和答案>>一定条件下,在一容积固定的密闭容器中充入2 molNO和1 mol O2,发生反应:2NO +O2=2NO2、
2NO2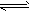 N2O4,下列推测中,正确的是
N2O4,下列推测中,正确的是
2NO2
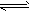 N2O4,下列推测中,正确的是
N2O4,下列推测中,正确的是[ ]
A.平衡时体系中含NO、O2、NO2、N2O4
B.平衡后容器中压强为开始时的2/3
C.达到平衡后,压缩容器容积,混合气体颜色变浅
D.达到平衡后,再充入少量O2混合气体颜色不变
查看习题详情和答案>>
B.平衡后容器中压强为开始时的2/3
C.达到平衡后,压缩容器容积,混合气体颜色变浅
D.达到平衡后,再充入少量O2混合气体颜色不变
(2012?海淀区一模)某化学课外活动小组通过实验研究NO2的性质.
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O
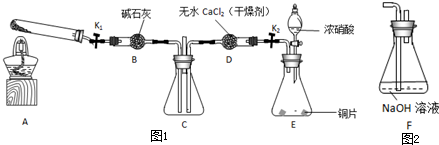
任务1:利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去).
(1)E装置中制取NO2反应的化学方程式是
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是
(3)实验过程中,未能观察到C装置中的预期现象.该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③
(4)此实验装置存在一个明显的缺陷是
任务2:探究NO2能否与Na2O2发生氧化还原反应.
(5)实验前,该小组同学提出三种假设.
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.
①装置的合理连接顺序是(某些装置可以重复使用)
②实验过程中,B装置中淡黄色粉末逐渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为
查看习题详情和答案>>
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O

任务1:利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去).
(1)E装置中制取NO2反应的化学方程式是
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
.(2)若NO2能够被NH3还原,预期观察到C装置中的现象是
C装置中混合气体颜色变浅
C装置中混合气体颜色变浅
.(3)实验过程中,未能观察到C装置中的预期现象.该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③
在此条件下,该反应的化学反应速率极慢
在此条件下,该反应的化学反应速率极慢
.(4)此实验装置存在一个明显的缺陷是
缺少尾气吸收装置
缺少尾气吸收装置
.任务2:探究NO2能否与Na2O2发生氧化还原反应.
(5)实验前,该小组同学提出三种假设.
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:
NO2能被Na2O2还原
NO2能被Na2O2还原
.(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.
①装置的合理连接顺序是(某些装置可以重复使用)
EDBDF或EDBF
EDBDF或EDBF
.②实验过程中,B装置中淡黄色粉末逐渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为
2NO2+Na2O2═2NaNO3
2NO2+Na2O2═2NaNO3
.(2011?丰台区二模)已知A、B、C、D、E为原子序数递增的五种短周期元素,A与C、B与D同主族.E是所在周期原子半径最小的元素,C、D质子数之和是A、B质子数之和的三倍,A元素某种同位素原子不含有中子.请根据以上信息回答:
(1)C2B2的电子式
 ,A2B2属于
,A2B2属于
(2)甲装置是离子交换膜法电解饱和CE溶液的原理示意图.透过交换膜的离子a是
(3)为检验E2的性质,某同学做了如下实验:
①Cu丝在E2中燃烧的现象
a.Fe与Cu都是金属元素
b.Fe的熔点比Cu高
c.Fe的密度比Cu小
d.Fe的金属性比Cu强
②将乙装置放置在光亮的地方(日光没有直接照射),一段时间后,观察到量筒壁上有油状液滴生成,量筒内气体颜色变浅等.生成的物质有
(4)D的单质能跟C的最高价氧化物对应的水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式
(5)用铂作电极电解1L含有0.4molCuDB4和0.2molCE的水溶液,一段时间后在一个电极上得到了0.3molCu,在另一极上析出的气体在标况下的体积是
查看习题详情和答案>>
(1)C2B2的电子式


分子
分子
晶体(“分子”、“原子”或“离子”).(2)甲装置是离子交换膜法电解饱和CE溶液的原理示意图.透过交换膜的离子a是
Na+
Na+
,电解的离子方程式2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
. Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-(3)为检验E2的性质,某同学做了如下实验:
①Cu丝在E2中燃烧的现象
产生棕黄色的烟
产生棕黄色的烟
,你认为Fe丝在E2也可点燃的理由是d
d
.a.Fe与Cu都是金属元素
b.Fe的熔点比Cu高
c.Fe的密度比Cu小
d.Fe的金属性比Cu强
②将乙装置放置在光亮的地方(日光没有直接照射),一段时间后,观察到量筒壁上有油状液滴生成,量筒内气体颜色变浅等.生成的物质有
5
5
种,水槽中的液体用饱和CE溶液而不用水的原因是降低Cl2在水中的溶解度,抑制Cl2和水的反应
降低Cl2在水中的溶解度,抑制Cl2和水的反应
.
(4)D的单质能跟C的最高价氧化物对应的水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式
3S+6OH-═2S2-+SO32-+3H2O
3S+6OH-═2S2-+SO32-+3H2O
.(5)用铂作电极电解1L含有0.4molCuDB4和0.2molCE的水溶液,一段时间后在一个电极上得到了0.3molCu,在另一极上析出的气体在标况下的体积是
4.48L
4.48L
.