网址:http://m.1010jiajiao.com/timu_id_199266[举报]
选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
D
D
D
D
C
A
D
B
题号
11
12
13
14
15
16
17
18
19
20
答案
C
A
C
B
A
D
B
C
B
D
21.(1)24FeSO4+30HNO3→8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O
(2)FeSO4 +5价N (3) 得到 4
22.(1)>。在亚硫酸氢钠溶液中,存在HSO3-的电离平衡:HSO3-  H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O
H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
 (2)含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色。加入少量氢氧化钠溶液时,只有HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
(2)含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色。加入少量氢氧化钠溶液时,只有HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
23.(1) 0.01mol/L. min
(2) a=0.05 mol/L 图象如右
(3) BD
24.(1)Br2 ;Fe3+
(2)
乙 同学正确
选用试剂
实验现象
第一种方法
C
有机层无色
第二种方法
D
溶液变红
(3)Fe2+;不可以,因为Br2和Fe3+都能把I―氧化成I2
25.(1)b;
(2)将亚铁离子氧化为铁离子;
(3)除去过量的硫酸;不引入新的杂质;
(4)Fe3++3H2O=Fe(OH)3↓+3H+;(条件:加热)
(5)抑制Cu2+的水解;产生污染环境的二氧化硫,硫酸利用率低;加热,并在稀硫酸中通入氧气。(注:本题为发散性试题,如有其它合理答案,酌情给分)
 26.
26. ⑴ C6H5-CH-18OH CH3CH2- -18OH
⑴ C6H5-CH-18OH CH3CH2- -18OH

 ⑵C6H5-CH-18OH+HCOOH
⑵C6H5-CH-18OH+HCOOH HCO18O-CH-C6H5+H2O
HCO18O-CH-C6H5+H2O
⑶

计算题
27.(1)0.8mol/L (2)29.6%
附加题
1.B
2.C
3.(1)除去混在氢气中的酸性气体
(2)A B、C; 将E中的产生的硫酸亚铁溶液压入D中
(3)②
(4)用氢氧化钠溶液除去混在氢气中的酸性气体;氢氧化钠溶液重复使用;用氢气驱赶氧气,防止亚铁盐被氧化;等其它合理答案
| 温度℃ | FeSO4?7H2O | (NH4)2SO4 | |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78,0 | 28.1 |
实验步骤流程图:
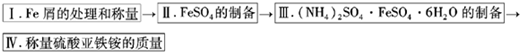
请完成以下实验记录:
(1)步骤I中处理铁屑所用试剂为
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入
(4)称量生成的硫酸亚铁铵的质量,理论上为
(7分) 在足量的稀氯化亚铁溶液中加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为是Br2溶于水变成黄色溶液;乙认为是Fe2+被氧化成Fe3+使溶液变成黄色。
(2)现提供试剂:
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 |
| C.四氯化碳 | D.硫氰化钾溶液 |
| | 选用试剂 | 实验现象 |
| 第一种方法 | | |
| 第二种方法 | | |
(7分) 在足量的稀氯化亚铁溶液中加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为是Br2溶于水变成黄色溶液;乙认为是Fe2+被氧化成Fe3+使溶液变成黄色。
(2)现提供试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液
C.四氯化碳 D.硫氰化钾溶液
请判断 (填“甲”或“乙”)的推断正确,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
|
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(3)若选用淀粉碘化钾溶液判断哪位同学推断正确,是否可行?(填“可行”或“不可行”): ;理由: 。
查看习题详情和答案>>
