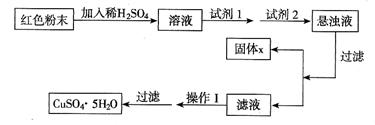
摘要:7实验有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3实验小组设计如下实验方案:
网址:http://m.1010jiajiao.com/timu_id_198925[举报]
题号
1
2
3
4
5
6
7
8
9
答案
C
D
D
C
D
C
C
C
B
题号
10
11
12
13
14
15
16
17
18
答案
C
A
D
C
D
B
D
A
C
19、(9分)(1)焰色(1分)。
(2)①Na2CO3(1分)静置,在上层清液中继续滴加Na2CO3溶液,若不再有沉淀生成,则加Na2CO3溶液已过量。(2分)
②盐酸(1分)除尽溶液中过量的Na2CO3(1分)
③稀HNO3和AgNO3溶液(1分) (其它合理答案也可)
 |

 ④
(2分,其它合理答案也可)
④
(2分,其它合理答案也可)
 (2分)(5)2(1分)
(2分)(5)2(1分)