网址:http://m.1010jiajiao.com/timu_id_189503[举报]
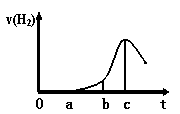 (10分)某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图。
(10分)某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图。
(1)关于图像的描述不正确的是 (填序号,下同);
① a → b段产生H2加快可能是表面的氧化膜逐渐溶解,加快了反应速率
② b → c段产生H2较快可能是该反应放热,导致温度升高,加快了反应
③ c以后,产生H2速率逐渐下降可能是铝片趋于消耗完全
(2)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL
0.5 mol·L-1硫酸的快,可能的原因是________;
①盐酸中c(H+)的浓度更大 ②Cl-有催化作用 ③SO42-有催化作用 ④SO42-有阻化作用(使反应变慢) ⑤Al3+有催化作用
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:
①加入某种催化剂; ②加入蒸馏水; ③将铝片换成铝粉;
④增加硫酸的浓度至18 mol/L; ⑤ ; ⑥ _。
以上方案不合理的有 ;请你再补充两种合理方案,填入空白⑤⑥处。
查看习题详情和答案>>成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断。将5.4g铝片投入500mL 0.5 mol·L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图。
(1)关于图像的描述不正确的是_③_____(2分)
①a→c段产生氢气的速率增加较快可能是表面的氧化膜逐渐溶解,加快了反应的速率
②a→c段产生氢气的速率增加较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生氢气的速率逐渐下降可能是铝片趋于消耗完全
(2)书写O→a段所对应的离子方程式____________________________________(2分)
(3)若其他条件不变,现换用500mL1mol·L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol·L-1硫酸的快,可能的原因是_②④_______(2分)
①盐酸中c(H+)的浓度更大 ②Cl—有催化作用 ③SO42—有催化作用
④SO42—有阻化作用 ⑤Al3+有催化作用
(4)根据所学,若要加快铝片与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②滴加少量CuSO4溶液;③将铝片剪成100条;④增加硫酸的浓度至18mol/L;⑤加入蒸馏水;⑥加入少量KNO3溶液;
⑦_____________。(2分)
其中,你认为不合理的方案有_____________(2分),并请你再补充一种合理方案,填入空白⑦处。
查看习题详情和答案>>(10分)成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断。将5.4g铝片投入500mL 0.5 mol·L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图。
(1)关于图像的描述不正确的是_③_____(2分)
①a→c段产生氢气的速率增加较快可能是表面的氧化膜逐渐溶解,加快了反应的速率
②a→c段产生氢气的速率增加较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生氢气的速率逐渐下降可能是铝片趋于消耗完全
(2)书写O→a段所对应的离子方程式____________________________________(2分)
(3)若其他条件不变,现换用500mL1mol·L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol·L-1硫酸的快,可能的原因是_②④_______(2分)
①盐酸中c(H+)的浓度更大 ②Cl—有催化作用 ③SO42—有催化作用
④SO42—有阻化作用 ⑤Al3+有催化作用
(4)根据所学,若要加快铝片与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②滴加少量CuSO4溶液;③将铝片剪成100条;④增加硫酸的浓度至18mol/L;⑤加入蒸馏水;⑥加入少量KNO3溶液;⑦_____________。(2分)
其中,你认为不合理的方案有_____________(2分),并请你再补充一种合理方案,填入空白⑦处。
(10分)成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断。将5.4g铝片投入500mL 0.5 mol·L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图。

(1)关于图像的描述不正确的是______(2分)
①a→c段产生氢气的速率增加较快可能是表面的氧化膜逐渐溶解,加快了反应的速率
②a→c段产生氢气的速率增加较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生氢气的速率逐渐下降可能是铝片趋于消耗完全
(2)书写O→a段所对应的离子方程式____________________________________(2分)
(3)若其他条件不变,现换用500mL1mol·L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol·L-1硫酸的快,可能的原因是________(2分)
①盐酸中c(H+)的浓度更大 ②Cl—有催化作用 ③SO42—有催化作用
④SO42—有阻化作用 ⑤Al3+有催化作用
(4)根据所学,若要加快铝片与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②滴加少量CuSO4溶液;③将铝片剪成100条;④增加硫酸的浓度至18mol/L;⑤加入蒸馏水;⑥加入少量KNO3溶液;⑦_____________。(2分)
其中,你认为不合理的方案有_____________(2分),并请你再补充一种合理方案,填入空白⑦处。
查看习题详情和答案>>
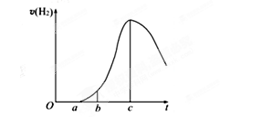
(1)关于图像的描述不正确的是_③_____(2分)
①a→c段产生氢气的速率增加较快可能是表面的氧化膜逐渐溶解,加快了反应的速率
②a→c段产生氢气的速率增加较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生氢气的速率逐渐下降可能是铝片趋于消耗完全
(2)书写O→a段所对应的离子方程式____________________________________(2分)
(3)若其他条件不变,现换用500mL1mol·L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol·L-1硫酸的快,可能的原因是_②④_______(2分)
①盐酸中c(H+)的浓度更大 ②Cl—有催化作用 ③SO42—有催化作用
④SO42—有阻化作用 ⑤Al3+有催化作用
(4)根据所学,若要加快铝片与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②滴加少量CuSO4溶液;③将铝片剪成100条;④增加硫酸的浓度至18mol/L;⑤加入蒸馏水;⑥加入少量KNO3溶液;⑦_____________。(2分)
其中,你认为不合理的方案有_____________(2分),并请你再补充一种合理方案,填入空白⑦处。