摘要:②反应2NH3的平衡常数K= c^2=0.005 25.(1)写出由化合物I合成化合物II的反应方程式:
网址:http://m.1010jiajiao.com/timu_id_181619[举报]
已知N2(g)+3H2(g)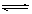 2NH3(g)
△H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g)
△H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
A.两个平衡状态的平衡常数的关系:KⅠ<KⅡ
B.H2的百分含量相同
C.N2的转化率:平衡I<平衡Ⅱ
D.反应放出的热量:QⅠ=QⅡ<92.3kJ
查看习题详情和答案>>
已知N2(g)+3H2(g) 2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
| A.两个平衡状态的平衡常数的关系:KⅠ<KⅡ |
| B.H2的百分含量相同 |
| C.N2的转化率:平衡I<平衡Ⅱ |
| D.反应放出的热量:QⅠ=QⅡ<92.3kJ |
已知N2(g)+3H2(g)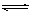 2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
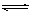 2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是| A.两个平衡状态的平衡常数的关系:KⅠ<KⅡ |
| B.H2的百分含量相同 |
| C.N2的转化率:平衡I<平衡Ⅱ |
| D.反应放出的热量:QⅠ=QⅡ<92.3kJ |
|
化学反应原理中涉及很多常数,下列说法错误的是 | |
| [ ] | |
A. |
反应N2(g)+3H2(g) |
B. |
化学平衡常数、弱电解质的电离平衡常数、溶度积常数均只受温度的影响 |
C. |
对于弱电解质的电离平衡常数,当温度一定时,电离平衡常数越小,其酸性越强 |
D. |
将AgNO3溶液和KCl溶液混合后,若c(Ag+)·c(Cl-)<KSP(AgCl),则溶液中无沉淀生成 |
 运用化学反应原理研究以下问题:
运用化学反应原理研究以下问题:(1)合成氨反应N2(g)+3H2(g)
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡向左
向左
移动(填“向左”、“向右”或“不”),平衡常数K不变
不变
(填“变大”、“变小”或“不变”);使用催化剂不改变
不改变
反应的△H(填“增大”、“减小”或“不改变”).(2)在25℃时,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+
Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+
.(已知25°CKsp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)(3)在25℃时,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
中
中
性(填“酸”、“碱”或“中”);且a>
>
0.01(填“>”、“=”或“<”).(4)依据反应:Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu(s) 设计的原电池如图所示:
电极X的材料是
Fe
Fe
;电解质溶液Y是硫酸铜溶液或氯化铜溶液等
硫酸铜溶液或氯化铜溶液等
;若Y为氯化钠溶液,则经过一段时间,发现X极上出现锈斑,则此过程中正极的电极反应式为O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.