网址:http://m.1010jiajiao.com/timu_id_181610[举报]
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是
(2)工业生产中利用上述反应后的溶液,按如下流程图1可制备胆矾(CuSO4?5H2O):
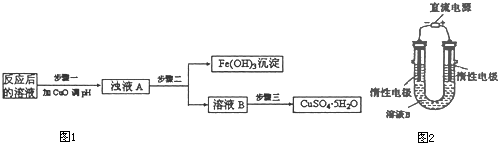
①分析下列表格(其中KSP是相应金属氢氧化物的沉淀溶解平衡常数):
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
②步骤三中的具体操作方法是
(3)有人提出可以利用图2的装置从溶液B中提炼金属铜.该过程中右边电极的反应式是
| ||
| ||
(4)工业上冶炼铜的方法之一为:Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g)△H
已知:①2Cu(s)+
| 1 |
| 2 |
②2Cu(s)+S(s)=Cu2S(s)△H=-79.5kJ?mol-1
③S(s)+O2(g)=SO2(g)△H=-296.8kJ?mol-1
则该法冶炼铜的反应中△H=
【化学——选修3:物质结构与性质】(15分)
用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:
(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、
②的化学方程式是 、 。
(2)基态铜原子的核外电子排布式为 ,硫、氧元素相比,第一电离能较大的是 。
(3)反应①和②生成的气体分子的中心原子的杂化类型是 ,分子的空间构型是 。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因 ;在该晶体中存在化学键的种类有 。
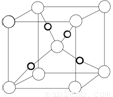
(5)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密
度为 g·cm-3(用NA表示阿伏加德罗常数的数值)。
查看习题详情和答案>>
【化学——选修3:物质结构与性质】(15分)
用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:
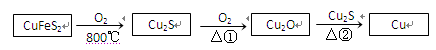
(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、
②的化学方程式是 、 。
(2)基态铜原子的核外电子排布式为 ,硫、氧元素相比,第一电离能较大的是 。
(3)反应①和②生成的气体分子的中心原子的杂化类型是 ,分子的空间构型是 。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因 ;在该晶体中存在化学键的种类有 。
(5)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密
度为 g·cm-3(用NA表示阿伏加德罗常数的数值)。
查看习题详情和答案>>
有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
回答下列问题:
(1)已知:
|
|
Fe2+ |
Cu2+ |
Fe3+ |
|
开始转化成氢氧化物沉淀时的pH |
7.6 |
4.7 |
2.7 |
|
完全转化成氢氧化物沉淀时的pH |
9.6 |
6.7 |
3.7 |
(1)加入CuO将溶液的pH调节到约为4,结合平衡移动原理解释该操作的原因 。
(2)写出能实现反应Ⅲ的化学方程式 。
(3)试剂b为 。
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、 、 。
(5)反应Ⅰ的化学方程式 。
查看习题详情和答案>>
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是________。
(2)工业生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O)


②步骤三中的具体操作方法是____________________。
(3)有人提出可以利用如图的装置从溶液B中提炼金属铜。该过程中右边电极的反应式是____________,总反应方程式是____________________。

已知:
①2Cu(s)+1/2O2(g)=Cu2O(s) △H=-12 kJ/mol
②2Cu(s)+S(s)=Cu2S(s) △H=-79.5 kJ/mol
③S(s)+O2(g)=SO2(g) △H=-296.8 kJ/mol
则该法冶炼铜的反应中△H=________。