网址:http://m.1010jiajiao.com/timu_id_181607[举报]
| 名称 | 性质 |
| 乙二醇 | 无色粘稠吸湿液体,易燃,沸点:196~198℃,与水混溶. |
| 丙酮 | 无色易燃液体,沸点:56.5℃,溶于水及大多数有机溶剂. |
| N,N二甲基甲酰胺(DMF) | 易燃,低毒,沸点:153℃,能与水和大多数有机溶剂混溶. |
| 对苯二甲酸(TPA) | 白色针状结晶或粉末,可燃,熔点:425℃(分解),约在300℃升华,不溶于水,微溶于热乙醇,溶于碱溶液.电离常数:Ka1=3.1×10-4,Ka2=1.5×10-5 |
(1)对苯二甲酸的制备
①在100mL四颈瓶上分别装置冷凝管、搅拌器和温度计.然后依次加入5.00g废饮料瓶碎片、0.05g氧化锌、5g碳酸氢钠和25mL乙二醇.缓慢搅拌,油浴加热,将温度升至180℃(不超过185℃),在此温度下反应15分钟.反应过程中的现象是
②冷却至160℃左右停止搅拌,将搅拌回流装置改成搅拌、减压蒸馏装置,减压蒸馏.这一步是为了分离出
③向四颈瓶中加入50mL沸水,搅拌使四颈瓶中的残留物溶解.抽滤除去少量不溶物.抽滤需要用到的主要仪器有
④将滤液转移到400mL烧杯中,用25mL水荡洗滤瓶并倒入烧杯中,再添加水使溶液总体积达200mL丙酮分2次洗涤,抽干,干燥.
(2)对苯二甲酸含量的测定
称取0.2000g对苯二甲酸样品于250mL烧杯中,加入30mL DMF,搅拌溶解,加入10mL蒸馏水,搅匀后加4滴酚酞指示剂,用0.1000mol?L-1氢氧化钠标准溶液滴定,消耗氢氧化钠标准溶液体积为22.60mL.
滴定终点的现象是
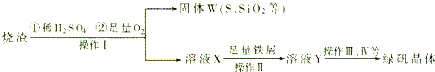
(1)固体W焙烧时产生某有毒气体,需以碱液吸收处理之,下列装置A~D中可选用

(2)实验过程中多次使用过滤操作.过滤操作中用到的玻璃仪器有
(3)写出溶液X中加铁屑发生反应的离子方程式
(4)测定绿矾产品中Fe2+含量的实验步骤:
a.称取5.7g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol?L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL(滴定时发生反应的离子方程式为:5Fe2++MnO
- 4 |
①计算上述产品中FeSO4?7H2O的质量分数为
②若用上述方法测定的产品中FeSO4?7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有(只回答一条即可)
I.铁是人体必须的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成份。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是 ;实验室在配制FeSO4溶液时常加入 以防止其被氧化,请你设计一个实验证明FeSO4溶液是否被氧化 。
(2)测定绿矾样品含量的实验步骤:
a. 称取5.7g样品,溶解,配成250mL溶液
b.量取25mL待测溶液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL
根据以上步骤回答下列问题:
①用硫酸酸化的KMnO4滴定终点的标志是 。
②计算上述产品中FeSO4·7H2O的质量分数为 。
II.硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(3)硫酸亚铁铵不易被氧化的原因 。
(4)为检验分解产物的成份,设计如下实验装置进行实验,加热A中硫酸亚铁铵至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是 。
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的观象为 。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)
查看习题详情和答案>>
Ⅰ某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与干燥Na2CO3 固体反应得到的固体物质的成分。
已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中固体含有NaHCO3 ,且含氯的盐只有一种。现对C的成分进行猜想和探究。

(1)提出合理猜想:若已知C中有0.1molCl2恰好和10.6克Na2CO3固体完全反应。则C中有Cl2参与反应的化学方程式可能 。
(2)①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 、 。
②设计合理方案对C固体中的未知成分进行探究。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、Ba(OH)2溶液、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量C中固体样品于试管中,加入足量蒸馏水,充分振荡至固体完全溶解,然后将所得溶液分装A、B两支试管中。 |
|
|
步骤2: |
|
|
步骤3: |
|
|
|
|
Ⅱ探究铁矿石中铁的含量将2. 25g铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250 mL,利用反应 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O 对铁矿石中铁元素的含量进行测定。
①现有烧杯、玻璃棒、量筒、胶头滴管,要配制0.0150 mol/L K2Cr2O7溶液100mL,还需要的玻璃仪器是 。
②取25mL待测液进行滴定,平均消耗 K2Cr2O7溶液体积为25.00 mL,则铁矿石中铁元素的百分含量是(Fe的相对原子质量为56) 。
③在本实验的滴定过程中,下列操作会使测定结果偏小的是 (填写序号)。
a.未用标准K2Cr2O7溶液润洗滴定管
b.锥形瓶中加入待测溶液后,再加少量水
c.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出
查看习题详情和答案>>
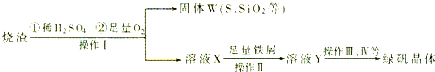
 +8H+═5Fe3++Mn2++4H2O)
+8H+═5Fe3++Mn2++4H2O)