网址:http://m.1010jiajiao.com/timu_id_181597[举报]
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
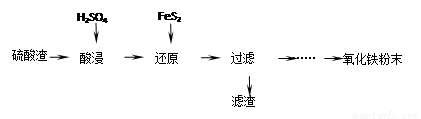
(1)“酸浸”中硫酸要适当过量,目的是①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同),
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
Mn(OH)2 |
|
开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
8.3 |
|
完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.分离,洗涤;
d.烘干,研磨。
查看习题详情和答案>>
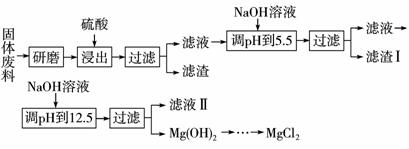
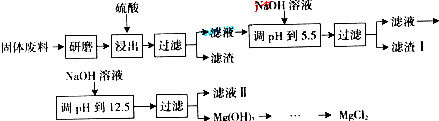
某厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 12.4 |
部分阳离子以氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有_______________(要求写出两条)
(2)滤渣Ⅰ的主要成分有____________。
(3)从滤液Ⅱ中可回收利用的主要物质有____________。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3=Mg(ClO3)2+2NaCl
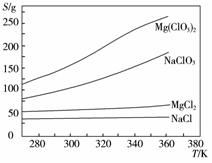
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:_________________。
②按①中条件进行制备实验。在冷却降温析出Mg
(ClO3)2过程中,常伴有NaCl析出,原因是:
_______________。除去产品中该杂质的方法是:____________。
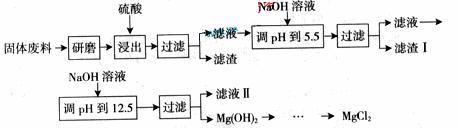
查看习题详情和答案>>![]() 某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
![]()
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
![]() 部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
![]() (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
![]() (2)滤渣I的主要成分有 。
(2)滤渣I的主要成分有 。
![]() (3)从滤渣Ⅱ中可回收利用的主要物质有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
![]() (4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
![]() MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
![]() 已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
![]()
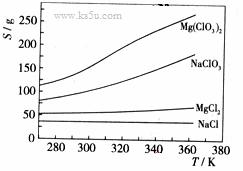
![]() ①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
![]() ②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
![]()
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
![]()

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
![]() 部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
![]() (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
![]() (2)滤渣I的主要成分有 。
(2)滤渣I的主要成分有 。
![]() (3)从滤渣Ⅱ中可回收利用的主要物质有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
![]() (4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
![]() MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
![]() 已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:![]()
![]()
![]()
![]()
![]()

![]() ①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
![]() ②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有______(要求写出两条).
(2)滤渣I的主要成分有______.
(3)从滤液Ⅱ中可回收利用的主要物质有______.
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3═Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:

①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因:______.
②按①中条件进行制备实验.在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:______.除去产品中该杂质的方法是:______. 查看习题详情和答案>>