摘要:C. 0.20mol/L Cu2+ D. 0.20mol/L Pb2+ [答案]C.[解析]考查:电解的原理应用及计算.
网址:http://m.1010jiajiao.com/timu_id_180763[举报]
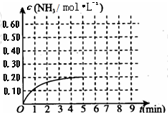 (2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=
(2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=0.02mol?L-1?min-1
0.02mol?L-1?min-1
.(2)该反应的化学平衡常数表达式为
| c(NH3)2 |
| c(N2).c(H2)3 |
| c(NH3)2 |
| c(N2).c(H2)3 |
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
ac
ac
(填序号)a.0.82mol?L-1 b.0.25mol?L-1 c.0.20mol?L-1 d.0.08mol?L-1
(4)反应达到平衡后,第5min末保持其他条件不变,若只把容器的体积缩小一半,平衡
向右
向右
移动(填“向右”、“向左”或“不”),化学平衡常数不变
不变
(填“增大”、“减少”或“不变”).(5)其它条件不变,在第5min末将容器的体积缩小一半,若第8min达到新的平衡(此时NH3的物质的量约为0.25mol),请在上图中画出第5min末到此平衡时NH3物质的量浓度的变化曲线.
已知铅蓄电池放电时发生如下反应:负极:Pb+SO42— -2e— =PbSO4,
正极:PbO2 + 4H+ + SO42— + 2e— = PbSO4 + 2H2O。实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g铜时,铅蓄电池内消耗H2SO4物质的量至少是
A.0.050mol B.0.075mol
C.0.20mol D.0.40mol
查看习题详情和答案>>
已知铅蓄电池放电时发生如下反应:负极:Pb+SO42— -2e— =PbSO4,
正极:PbO2 + 4H+ + SO42— + 2e— = PbSO4 + 2H2O。实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g铜时,铅蓄电池内消耗H2SO4物质的量至少是
A.0.050mol B.0.075mol
C.0.20mol D.0.40mol
查看习题详情和答案>>(08年全国卷)电解100mL含c(H+)=0.30mol/L的下列溶液。当电路中通过0.04mol电子时,理论上析出金属质量最大的是()
A.0.10mol/L Ag+
B. 0.20mol/L Zn2+
C. 0.20mol/L Cu2+
D. 0.20mol/L Pb2+
查看习题详情和答案>>
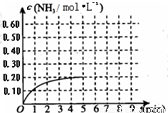
某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=______.
(2)该反应的化学平衡常数表达式为______.
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______(填序号)
a.0.82mol?L-1 b.0.25mol?L-1 c.0.20mol?L-1 d.0.08mol?L-1
(4)反应达到平衡后,第5min末保持其他条件不变,若只把容器的体积缩小一半,平衡______移动(填“向右”、“向左”或“不”),化学平衡常数______(填“增大”、“减少”或“不变”).
(5)其它条件不变,在第5min末将容器的体积缩小一半,若第8min达到新的平衡(此时NH3的物质的量约为0.25mol),请在上图中画出第5min末到此平衡时NH3物质的量浓度的变化曲线.
 查看习题详情和答案>>
查看习题详情和答案>>
(2)该反应的化学平衡常数表达式为______.
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______(填序号)
a.0.82mol?L-1 b.0.25mol?L-1 c.0.20mol?L-1 d.0.08mol?L-1
(4)反应达到平衡后,第5min末保持其他条件不变,若只把容器的体积缩小一半,平衡______移动(填“向右”、“向左”或“不”),化学平衡常数______(填“增大”、“减少”或“不变”).
(5)其它条件不变,在第5min末将容器的体积缩小一半,若第8min达到新的平衡(此时NH3的物质的量约为0.25mol),请在上图中画出第5min末到此平衡时NH3物质的量浓度的变化曲线.
 查看习题详情和答案>>
查看习题详情和答案>>