摘要:已知乙酸弱.在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中.下列排列正确的是A.c(OH―)>c >c(H+) B. c(OH―)>c(A―)>c(B―) >c(H+) C. c(OH―)>c(B―)>c(A―) >c(H+) D. c(OH―)>c >c(H+)[答案]A.[解析]考查:电解质溶液中酸的电离.盐类的水解等知识.酸越弱.对应的盐的水解程度越大.故同浓度的NaA和NaB.前者水解程度更大.因此其溶液中HA的浓度更大一些.盐类的水解一般来说是一些比较弱的反应.盐溶液中水解生成的分子的浓度要远小于原来的盐电离出的离子的浓度.又因为盐类水解的实质是阴离子或阳离子结合了水电离出的氢离子或氢氧根离子.使得其相应浓度剧烈减小.一般的.要小于生成的弱电解质分子的浓度.
网址:http://m.1010jiajiao.com/timu_id_180760[举报]
已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A.c(OH)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
查看习题详情和答案>>已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA
和NaB混合溶液中,下列排序正确的是( )
A.c( )>c(A-)>c(B-)>c(H+) B.c(OH—)>c(HA)>c(HB)>c(H+)
)>c(A-)>c(B-)>c(H+) B.c(OH—)>c(HA)>c(HB)>c(H+)
C.c( )>c(B-)>c(A-)>c(H+) D. c(
)>c(B-)>c(A-)>c(H+) D. c( )>c(HB)>c(HA)>c(H+)
)>c(HB)>c(HA)>c(H+)
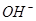 )>c(A-)>c(B-)>c(H+)
B.c(OH—)>c(HA)>c(HB)>c(H+)
)>c(A-)>c(B-)>c(H+)
B.c(OH—)>c(HA)>c(HB)>c(H+)