网址:http://m.1010jiajiao.com/timu_id_176036[举报]
第Ⅰ卷(选择题 共48分)
题号
1
2
3
4
5
6
7
8
答案
A
C
C
C
B
B
A
D
题号
9
10
11
12
13
14
答案
AB
D
C
B
BD
CD
第Ⅱ卷(非选择题部分 共72分)
15.(10分)(1)①B(1分) ②蒸馏烧瓶(1分) ③气密性检查(2分)
④大气压(或开始时烧瓶内的压强)(1分) 强(1分)
开始一段时间内曲线a的变化值大于曲线b。(2分)
(2)①有利于控制氧气的量 ②有利于二氧化锰的回收
③有利于控制氧气的生成速率(答出任意两点即可,每空1分)
16.(12分)(1)② 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- (2分)
 |
⑤ NH4++HCO3-+2OH- CO32-+NH3↑+2H2O(2分)
(2)过滤(1分) 加热(1分) (3)碱石灰(或硅胶)(1分)
(4)AlN(2分) 配位键(1分)
(5)产生等量的NH3时,(NH4)2CO3所消耗的NaOH的量是NH4HCO3一半。(2分)
17.(10分)⑴ 0.125 4.69 ⑵增大 > ⑶0.25 不变 (以上每空1分)
(4)6 1.25 (每空2分)
18.(10分)(1)②⑥(2分)
(2)C: (1分) F:
(1分) F:
 (1分)
(1分)
(3)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 +H2O(2分)
+H2O(2分) (2分)
(2分)
 sp3 三角锥形(每空1分)
sp3 三角锥形(每空1分) 解得
解得 (2分)
(2分)  (2分)
(2分) 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题: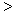 ”、 “
”、 “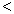 ”或“=”), △H=_____________。
”或“=”), △H=_____________。 2NH3(g);ΔH=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1mol NH3。现在相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ。则x、y的值为
2NH3(g);ΔH=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1mol NH3。现在相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ。则x、y的值为