网址:http://m.1010jiajiao.com/timu_id_175896[举报]
题号
1
2
3
4
5
6
7
8
答案
D
C
D
D
C
C
B
B
题号
9
10
11
12
13
14
15
16
17
18
答案
D
A
A
AB
AD
C
C
C
BC
C
19.A
20.①I-、Ba2+、NH4+
②Fe3+、NO3-、Mg2+、SO42-、CO32-、Al3+
③K+、Cl-
21.(1)C F G
(2)Fe3+ +3NH3H2O=Fe(OH)3 ↓+ 3 NH4+
(3)6Fe2+ + ClO3― + 6 H+ = 6Fe3+ + Cl― + 3H2O ,无影响,3:1
(4)坩埚
继续加热,放置干燥器中冷却,称量,至最后两次称得的质量差不超过
 (5)
(5) 4次
4次
×2× g×100%
g×100%
22.(1)H2O2溶液或H2O,少量的MnO2粉末或Na2O2;C。
(2)排水法收集--广口瓶中盛满水 , NO 从 d 管通入
(3)浓盐酸、KMnO4、NaBr溶液、溶液由无色变橙色(黄色)
23.4NxHy+yO2 →2xN2+2yH2O 反应前后质量守恒,同温同压下气体密度与气体体积成反比 x=2,y=4 N2H4

24.(1)n(NaClO)┱n(NaClO3)=1┱2
(2)7Cl2+14NaOH=NaClO+2NaClO3+11NaCl+7H2O
(3)c(NaClO)=0.2mol/L
c(NaClO3)=0.4moL/L c(NaCl)=2.2mol/L
①称量ag样品,置于烧杯中,
②加入适量的蒸馏水,使样品溶解,然后准确配制成250mL溶液
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全
⑤过滤,洗涤沉淀
⑥将沉淀声称到坩埚内加热,搅拌直到固体全部由红褐色变为红棕色后在干燥器中冷却到室温后,称量
⑦…根据上面叙述,回答
(1)如图所示仪器中,本实验步骤①②中必须用到的仪器是______.

(2)写出步骤③和④中发生反应的离子方程式______
(3)洗涤是洗去附着在沉淀上的______(写离子符号).洗涤沉淀的操作是______检验沉淀已洗净的方法是______
(4)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为______(列出算式,不需化简)
(5)该兴趣小组中甲学生认为:实验步骤中不加氯水,其余步骤不变,仍可达到实验目的,你认为甲学的观点是否正确______(填“正确”或“错误”)请说明理由(必要时可用化学方程式表示)______.
①称量ag样品,置于烧杯中,
②加入适量的蒸馏水,使样品溶解,然后准确配制成250mL溶液
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全
⑤过滤,洗涤沉淀
⑥将沉淀声称到坩埚内加热,搅拌直到固体全部由红褐色变为红棕色后在干燥器中冷却到室温后,称量
⑦…根据上面叙述,回答
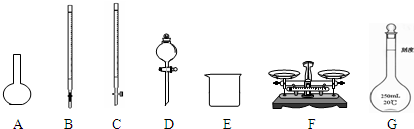
(1)如图所示仪器中,本实验步骤①②中必须用到的仪器是______.

(2)写出步骤③和④中发生反应的离子方程式______
(3)洗涤是洗去附着在沉淀上的______(写离子符号).洗涤沉淀的操作是______检验沉淀已洗净的方法是______
(4)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为______(列出算式,不需化简)
(5)该兴趣小组中甲学生认为:实验步骤中不加氯水,其余步骤不变,仍可达到实验目的,你认为甲学的观点是否正确______(填“正确”或“错误”)请说明理由(必要时可用化学方程式表示)______.
查看习题详情和答案>>
①称取a g样品,置于烧杯中;
②加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦….
请根据上面叙述,回答:
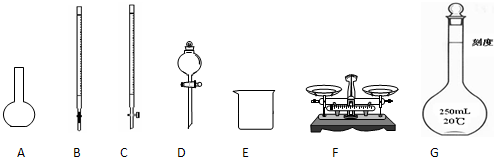
(1)图所示仪器中,本实验步骤①②③中必须用到的仪器是E和
(2)步骤②中加入盐酸的作用
(3)写出步骤④中发生反应的离子方程式
(4)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成
(5)第⑥步的操作中,将沉淀物转移到
(6)本实验需要称量的最少次数是
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
(7)已知Cl2与热的NaOH溶液可发生如下反应:
3Cl2+6NaOH
| ||
则Fe3+、KClO3、Cl2三种物质其氧化性由强到弱的顺序是
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦重复以上操作,至最后两次称得的质量不超过0.1g为止.
请根据上面叙述,回答:
(1)如图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和
(2)步骤②加入盐酸的目的是
(3)写出步骤③中发生反应的离子方程式
(4)步骤⑤的洗涤是洗去附着在沉淀上的
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和 (填字母)。

(2)步骤②加入盐酸的目的是 ;加快样品溶解的最简单操作是 。
(3)写出步骤③中发生反应的离子方程式 。
(4)步骤⑤的洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为 。
查看习题详情和答案>>