网址:http://m.1010jiajiao.com/timu_id_174259[举报]
(10分)760℃和101.3kPa下,令氢气和氦气(体积比为1 :1)慢慢通过盛有熔融AgBr的舟皿,而使部分AgBr还原为Ag。然后让反应后的气体通过盛有40.00 mL 0.1000 mol?L-1NaOH的洗气瓶(溴单质被NaOH溶液吸收时,所生成的盐是两种强酸盐),并收集干燥后的尾气。某次实验后,洗气瓶内的溶液可以被l0.00 mL 0.1000 mol?L-1的HCl溶液中和,并在27.0℃ 101.3kPa下收集得干燥尾气492.4mL(已知760℃时纯HBr气体有16.67%分解为单质)。
(1)写出该实验过程中所发生的全部反应的方程式,并配平。
(2)计算舟皿中银单质的物质的量。
(3)计算尾气中氢气的物质的量。
查看习题详情和答案>>(10分)铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s) + 2H+(aq) == Cu2+(aq) + H2(g) △H= +64.39kJ/mol
2H2O2(l) == 2H2O(l) + O2 (g) △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)== H2O(l) △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml 5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围 ,向反应后溶液中加入4mol/L NaOH溶液 ml,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为 ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量 g。(用含a的代数式表示)
查看习题详情和答案>>
A.燃烧时 NO2作氧化剂
B.氮气既是氧化产物又是还原产物
C.生成1 mol N2转移8 mol e-
D.该反应的热化学方程式为2N2H4(g)+2NO2(g)![]() 3N2(g)+4H2O(g);ΔH=-1 135.7 KJ·mol-1
3N2(g)+4H2O(g);ΔH=-1 135.7 KJ·mol-1
(每空2分,共18分)在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);△H =QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
|
序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
8 0 0 ℃ |
n2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= mol/(L·min);实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q_ 0(填“>、=、<”),理由是_
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如右图所示,根据图中所示判断下列说法正确的__ __。
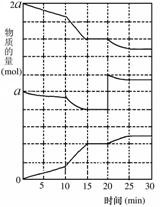
a.10~15 min可能是升高了温度
b.10~15 min可能是加入了催化剂
c.20 min时可能是缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA (g)和3molB(g),此时容器的压强为P(始)。
反应进行并达到平衡后,测得容器内气体压强为P(始)的 。若相同条件下,向上述
容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压
强仍为P(始)的 。
①a、b、c必须满足的关系是 , 。
(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是 。
查看习题详情和答案>>
(08安庆模拟)2006年1月12日美国升空的探测器在7月4日与“彗星相撞,产生4.5吨
TNT当量爆炸威力。其火箭推进剂仍然以肼(N2H4)作为主要燃料,NO2为氧化剂,反应生成
N2和水蒸气。已知N2(g)+2O2(g)= 2NO2(g);ΔH= +67.7KJ/mol,
N2H4(g)+O2(g)=N2(g)+2H2O (g);ΔH= ―534KJ/mol。下列关于肼和NO2反映的热化学方程式中,正确的是( )
A. 2 N2H4(g)+2 NO2(g)=3 N2(g)+4H2O (l); ΔH= ―1135.7KJ/mol
B. 2 N2H4(g)+2 NO2(g)=3 N2(g)+4H2O (g); ΔH= ―1000.3KJ/mol
C. N2H4(g)+ NO2(g)=![]() N2(g)+2H2O (l); ΔH= ―1135.7KJ/mol
N2(g)+2H2O (l); ΔH= ―1135.7KJ/mol
D. 2 N2H4(g)+2 NO2(g)=3 N2(g)+4H2O (g); ΔH= ―1135.7KJ/mol
查看习题详情和答案>> 实验
实验