摘要:NaCl,2Br- + Cl2 ==2Cl- + Br2
网址:http://m.1010jiajiao.com/timu_id_168113[举报]
(2013?奉贤区二模)综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如图所示:

完成下列填空
(1)实验室提纯粗盐的实验操作依次为:取样、
(2)气体X是
(3)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
(4)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为
(5)由MgCl2?6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:

①上图中,装置a由
②循环物质甲的名称是
③制取无水氯化镁必须在氯化氢存在的条件下进行,主要原因是
④装置b中填充的物质可能是
e.硅胶 f.碱石灰 g. 无水氯化钙 h.浓硫酸
⑤方框中的d装置可选择

查看习题详情和答案>>

完成下列填空
(1)实验室提纯粗盐的实验操作依次为:取样、
溶解
溶解
、过滤
过滤
;加热浓缩、结晶
结晶
、过滤(或过滤;洗涤)
过滤(或过滤;洗涤)
、烘干.(2)气体X是
NH3
NH3
(填化学式),溶液II中发生反应的化学方程式是:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
.(3)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
HNO3、AgNO3
HNO3、AgNO3
.(4)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为
Cl2+2Br-═Br2+2Cl-
Cl2+2Br-═Br2+2Cl-
.(5)由MgCl2?6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:

①上图中,装置a由
圆底烧瓶
圆底烧瓶
、分液漏斗
分液漏斗
、双孔塞和导管组成②循环物质甲的名称是
盐酸
盐酸
,③制取无水氯化镁必须在氯化氢存在的条件下进行,主要原因是
抑止镁离子水解
抑止镁离子水解
,④装置b中填充的物质可能是
eg
eg
(填入编号)e.硅胶 f.碱石灰 g. 无水氯化钙 h.浓硫酸
⑤方框中的d装置可选择
AD
AD
.
综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示: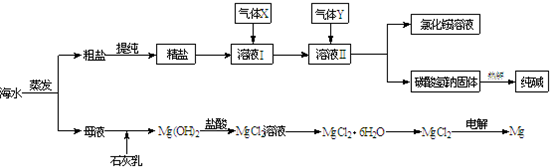
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;
②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤
(2)溶液Ⅱ中发生反应的化学方程式是:
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用
(4)高温灼烧六水合氯化镁晶体(MgCl2?6H2O)所得固体是氧化镁,试写出该反应的化学方程式
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为:
查看习题详情和答案>>

(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;
②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤
过滤
过滤
;⑥加适量的盐酸;⑦蒸发结晶
蒸发结晶
.(2)溶液Ⅱ中发生反应的化学方程式是:
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
.(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用
MgCl2
MgCl2
溶液进行洗涤以除之.(4)高温灼烧六水合氯化镁晶体(MgCl2?6H2O)所得固体是氧化镁,试写出该反应的化学方程式
MgCl2?6H2O=MgO+2HCl↑+5H2O↑
MgCl2?6H2O=MgO+2HCl↑+5H2O↑
.(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为:
Cl2+2Br-=2Cl-+Br2
Cl2+2Br-=2Cl-+Br2
.我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务.
(1)海水中所含元素质量最大的是
(2)①从海水中提取粗盐采用的方法是
②工业上常以食盐为原料制备氯气,再用氯气制备漂白粉,用化学方程式表示工业上制漂白粉的原理
(3)提取NaCl后剩余的海水(母液)中,可用来提取Mg和Br2.
①如用来提取Mg,请完成具体工业流程(注:( )内填所需试剂,【】内填操作)
②根据上述提取镁的全过程,没有涉及到的反应类型是
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
③若用来提取Br2,用离子方程式表示提取溴的原理:
④方法A:母液提取Mg后,再用来提取Br2;方法B:母液提取Br2后,再用来提取Mg.哪个更合适
查看习题详情和答案>>
(1)海水中所含元素质量最大的是
O
O
(写元素符号),被称作海洋元素的是Br
Br
(写元素符号).(2)①从海水中提取粗盐采用的方法是
蒸发结晶
蒸发结晶
,粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为A盐酸、B氯化钡溶液、C氢氧化钠溶液、D碳酸钠溶液,以上试剂添加的顺序为CBDA(其它合理答案即可)
CBDA(其它合理答案即可)
.②工业上常以食盐为原料制备氯气,再用氯气制备漂白粉,用化学方程式表示工业上制漂白粉的原理
Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O
Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O
(3)提取NaCl后剩余的海水(母液)中,可用来提取Mg和Br2.
①如用来提取Mg,请完成具体工业流程(注:( )内填所需试剂,【】内填操作)

②根据上述提取镁的全过程,没有涉及到的反应类型是
C
C
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
③若用来提取Br2,用离子方程式表示提取溴的原理:
Cl2+2Br-=2Cl-+Br2
Cl2+2Br-=2Cl-+Br2
.④方法A:母液提取Mg后,再用来提取Br2;方法B:母液提取Br2后,再用来提取Mg.哪个更合适
B
B
(填“A”或“B”),你的理由是若先提取镁,海水中会残留大量Ca(OH)2,再用Cl2提取溴时会消耗大量Cl2
若先提取镁,海水中会残留大量Ca(OH)2,再用Cl2提取溴时会消耗大量Cl2
.海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:
回答下列问题:
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①气体A、B是CO2或NH3,则气体A应是
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品
NH4Cl晶体,则通入NH3的作用是
(3)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.
a、写出步骤①④反应的离子方程式:①
b、在步骤⑥的蒸馏过程中,温度应控制在80-90℃、温度过高过低都不利于生产,请解释原因:
c、在步骤①、②之后并未直接用“含溴的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是
查看习题详情和答案>>

回答下列问题:
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是
CBDA或BCDA
CBDA或BCDA
.②电解饱和食盐水时,与电源正极相连的电极上发生的反应为
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
,与电源负极线连的电极附近溶液pH变大
变大
(变大、不变、变小).(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①气体A、B是CO2或NH3,则气体A应是
NH3
NH3
(填化学式).C的制得发生反应的化学方程式为2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
.
| ||
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品
NH4Cl晶体,则通入NH3的作用是
氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
.(3)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.
a、写出步骤①④反应的离子方程式:①
2Br-+Cl2=2Cl-+Br2
2Br-+Cl2=2Cl-+Br2
;④SO2+Br2+2H2O=2HBr+H2SO4
SO2+Br2+2H2O=2HBr+H2SO4
.b、在步骤⑥的蒸馏过程中,温度应控制在80-90℃、温度过高过低都不利于生产,请解释原因:
温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
.c、在步骤①、②之后并未直接用“含溴的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是
“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.
“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.
.