网址:http://m.1010jiajiao.com/timu_id_161447[举报]
某课外研究小组,用含有较多杂质的铜(主要杂质为Fe),通过下列化学反应制取胆矾并回收铁单质.请回答相关问题:

pH控制可参考下列数据:
| 物 质 | 开始沉淀时的pH | 完全沉淀时的pH |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
加入试剂A以后,金属铜也能逐渐溶解,写出该反应的离子方程式
能否用稀硝酸代替试剂A
(2)Cu(OH)2的作用是
还可以用
(3)操作2中包含3个基本实验操作,依次为
(4)如何对操作1后所得滤渣进行洗涤?简述洗涤操作步骤
(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.

①检验的试剂:
A.无水硫酸铜
B.酸性高锰酸钾溶液
C.水
D.氢氧化钠溶液
②除杂试剂:
A.无水硫酸铜
B.乙酸
C.新制的生石灰
D.溴水
③写出除杂时,乙烯发生反应的化学方程式:________________.
(2)如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀.按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验.

试回答:
在右试管中通常加入________溶液,实验生成的乙酸乙酯,其密度比水________,是有特殊香味的液体.分离右试管中所得乙酸乙酯的操作为(只填名称)________.反应中加入浓硫酸的作用是________.
制备方程式:________
(14分,每空2分)
硫酸亚铁容易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O
(NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、
洗涤、干燥、称量,铁屑质量为 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,
趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,
缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为 。
。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是 (填字母)。
A.纯碱溶液 B.烧碱溶液 C.明矾溶液 D.稀硫酸
(2)步骤2中趁热过滤的目的是 。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为 。
(4)铁屑表面常有少量的铁锈(Fe2O3· H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答)
。[来源:Zxxk.Com]
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答)
。[来源:Zxxk.Com]
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为 。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。
查看习题详情和答案>>
(14分,每空2分)硫酸亚铁容易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O (NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、
洗涤、干燥、称量,铁屑质量为![]() 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,
趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为![]() 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,
缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为![]() 。
。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是 (填字母)。
A.纯碱溶液 B.烧碱溶液 C.明矾溶液 D.稀硫酸
(2)步骤2中趁热过滤的目的是 。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为 。
(4)铁屑表面常有少量的铁锈(Fe2O3·![]() H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为 。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。
查看习题详情和答案>>
(14分,每空2分) 硫酸亚铁容易被氧化,而硫酸亚铁 铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀)
铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O (NH4)2SO4·FeSO4·6H2 O
O
步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、
洗涤、干燥、称量,铁屑质量为 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,
趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为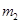 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌 使之溶解,
使之溶解,
缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所 得晶体质量为
得晶体质量为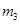 。
。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是 (填字母)。
| A.纯碱溶液 | B.烧碱溶液 | C.明矾溶液 | D.稀硫酸 |
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质
 (碱式硫酸铁),该反应的化学方程式为 。
(碱式硫酸铁),该反应的化学方程式为 。(4)铁屑表面常有少量的铁锈(Fe2O3·
 H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵
 晶体的产率为
晶体的产率为  。
。(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。 查看习题详情和答案>>