网址:http://m.1010jiajiao.com/timu_id_159098[举报]
1.D 2.D 3.B 4.D 5.D 6.B 7.A 8.C
9.C 10.AB 11.D 12.C 13.C 14.C
15.(1)检验反应中生成的H2 (2分)
(2)Fe Fe3O4溶于盐酸生成的Fe3+ 与Fe反应生成了Fe2+ (2分)
(3)① 2Fe2++2H++H2O2=2Fe3++2H2O (2分)
②取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,表明沉淀已洗涤干净 (2分)
③固体样品质量和红褐色固体的质量 (2分)
(本题共10分,其它合理答案参照给分)
 (3)相同温度下,K2SO4 的溶解度小于KCl、(NH4)2SO4
及NH4Cl
(3)相同温度下,K2SO4 的溶解度小于KCl、(NH4)2SO4
及NH4Cl
(4)CaO、H2O 或Ca(OH)2
(5) 原子利用率高,没有有害物质排放到环境中 (每空2分,共10分)
19.(1)  (2)酸性KMnO4溶液 (3) 3
(2)酸性KMnO4溶液 (3) 3
(4) 
 |
(5)
(6) 
 (每空2分,共12分)
(每空2分,共12分)
20.(1) (C6H10O5)n+nH2O 3nCH4↑+3nCO2↑ (2分)
(2)9.20 (
(3) 设反应③中消耗O2的物质的量为x,则N2的物质的量为4x
2CH4+O2→4H2+2CO CH4 + H2O → 3H2 + CO
2x x 4x 2x 1×103-2x (1×103-2x)×3 (1×103-2x)
合成二甲醚反应中CO和H2为1∶2,合成氨反应中,N2与H2体积比为1∶3,则
4x+(1×103-2x)×3-[2x+(1×103-2x)]×2=4x×3 (3分,关系式)
x=1000/14 mol
NH3
:4x×2×17=
答略。(本题共10分,其它合理答案参照给分)
21.(1) 1s22s22p63s23p63d54s2 (2分)
Mn2+的3d轨道电子排布为半满状态较稳定 (2分)
(2) 直线型 (2分) CO2 (2分)
(3) 1:2 (1分)  (1分) 30 (2分)
(1分) 30 (2分)
本资料由《七彩教育网》www.7caiedu.cn 提供!
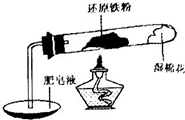 铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4.
(1)实验中使用肥皂液的作用是
(2)甲同学对实验后试管内的黑色固体X含有哪些物质进行了探究.
提出假设:①所得固体是FeO
②所得固体是Fe3O4
③所得固体是
实验探究:
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热. | 黑色粉末逐渐溶解,有少量气泡产生. |
| ② | 取试管1反应后的溶液少许,滴加几滴KSCN溶液,振荡. | 溶液没有出现血红色. |
| ③ | 取试管1反应后的溶液少许,滴加几滴酸性KMnO4溶液,振荡 | 高锰酸钾溶液褪色 |
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4.
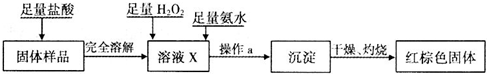
①溶液X中发生氧化还原反应的离子方程式为
②操作a包括过滤和洗涤,检验沉淀是否已经洗涤干净的操作是
③如果取固体样品m1克,反应后得到红棕色固体m2克,则m1与m2之比最少应大于
(8分)铁不能与冷、热水反应,但能与水蒸气反应。如下图所示,在装置的硬质玻璃管内放入还原铁粉和石棉绒的混合物,通入水蒸气,加热,就可以完成高温下“Fe与水蒸气反应的实验”。
请回答下列问题:
(1)写出反应的化学方程式: 。
(2)实验开始时,应先点燃 (填写“酒精灯”或“酒精喷灯”),。
(3)干燥管中盛装的物质可以是 (填写一种即可),检验气体A的方法:
。
查看习题详情和答案>>

