网址:http://m.1010jiajiao.com/timu_id_159079[举报]
1.D 2.D 3.B 4.D 5.D 6.B 7.A 8.C
9.C 10.AB 11.D 12.C 13.C 14.C
15.(1)检验反应中生成的H2 (2分)
(2)Fe Fe3O4溶于盐酸生成的Fe3+ 与Fe反应生成了Fe2+ (2分)
(3)① 2Fe2++2H++H2O2=2Fe3++2H2O (2分)
②取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,表明沉淀已洗涤干净 (2分)
③固体样品质量和红褐色固体的质量 (2分)
(本题共10分,其它合理答案参照给分)
 (3)相同温度下,K2SO4 的溶解度小于KCl、(NH4)2SO4
及NH4Cl
(3)相同温度下,K2SO4 的溶解度小于KCl、(NH4)2SO4
及NH4Cl
(4)CaO、H2O 或Ca(OH)2
(5) 原子利用率高,没有有害物质排放到环境中 (每空2分,共10分)
19.(1)  (2)酸性KMnO4溶液 (3) 3
(2)酸性KMnO4溶液 (3) 3
(4) 
 |
(5)
(6) 
 (每空2分,共12分)
(每空2分,共12分)
20.(1) (C6H10O5)n+nH2O 3nCH4↑+3nCO2↑ (2分)
(2)9.20 (
(3) 设反应③中消耗O2的物质的量为x,则N2的物质的量为4x
2CH4+O2→4H2+2CO CH4 + H2O → 3H2 + CO
2x x 4x 2x 1×103-2x (1×103-2x)×3 (1×103-2x)
合成二甲醚反应中CO和H2为1∶2,合成氨反应中,N2与H2体积比为1∶3,则
4x+(1×103-2x)×3-[2x+(1×103-2x)]×2=4x×3 (3分,关系式)
x=1000/14 mol
NH3
:4x×2×17=
答略。(本题共10分,其它合理答案参照给分)
21.(1) 1s22s22p63s23p63d54s2 (2分)
Mn2+的3d轨道电子排布为半满状态较稳定 (2分)
(2) 直线型 (2分) CO2 (2分)
(3) 1:2 (1分)  (1分) 30 (2分)
(1分) 30 (2分)
本资料由《七彩教育网》www.7caiedu.cn 提供!
氧化还原反应在生产和生活中使用非常广泛。
I(4分)、一个体重50 kg的健康人含铁2 g,这2 g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是__________。
A. Fe B. Fe2+ C. Fe3+
(2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有________性。下列也能实现这种转化的物质是________。
A. Cl2 B. O2 C. FeCl3 D.浓硫酸
(3)工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有________性。
II(8分)、某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As——砷)
![]() (1)已知KBrO3中的溴元素在反应中得到电子,则该反应的还原剂是 。
(1)已知KBrO3中的溴元素在反应中得到电子,则该反应的还原剂是 。
![]() (2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X中Br的化合价为 。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X中Br的化合价为 。
![]() (3)根据上述反应可推知 。
(3)根据上述反应可推知 。
![]() a.氧化性:
a.氧化性:![]() b.氧化性:
b.氧化性:![]()
![]() c.还原性:
c.还原性:![]() d.还原性:
d.还原性:![]()
![]() (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方![]() 向和数目:
向和数目:
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+ =□Fe(OH)3↓+□C1-+
②检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:2Al+3HO2-=2AlO2-+OH-+H2O

①正极反应式为 。
②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的
原因之一,电极被腐蚀的离子方程式为 。
(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在)。不采用氯化铝溶液的原因是 。
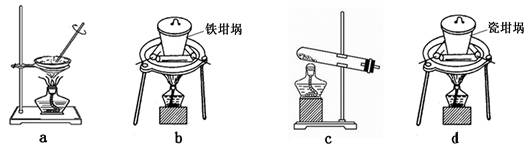
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
查看习题详情和答案>>
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。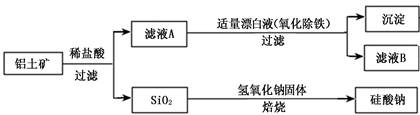
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+ =□Fe(OH)3↓+□C1-+
②检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:2Al+3HO2-=2AlO2-+OH-+H2O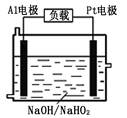
①正极反应式为 。
②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的
原因之一,电极被腐蚀的离子方程式为 。
(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在)。不采用氯化铝溶液的原因是 。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。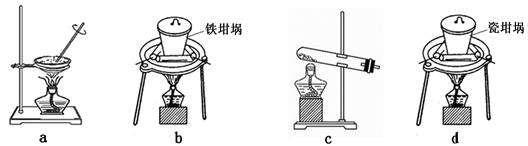
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+ =□Fe(OH)3↓+□C1-+ 。
②检验滤液B中是否还含有铁元素的方法为:
(注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
 (填操作名称)、洗涤。
(填操作名称)、洗涤。
(2) 已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:2Al+3HO2-=2AlO2-+OH-+H2O
①正极反应式为 。
②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的
原因之一,电极被腐蚀的离子方程式 为 。
(3)钢材镀铝可以防止钢材腐蚀,不采用氯化铝溶液的原因是 。是 。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
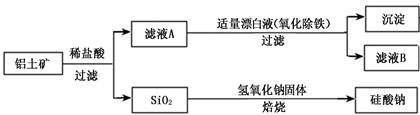
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+ =□Fe(OH)3↓+□C1-+
②检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:2Al+3HO2-=2AlO2-+OH-+H2O
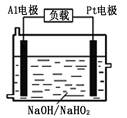
①正极反应式为 。
②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的
原因之一,电极被腐蚀的离子方程式为 。
(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在)。不采用氯化铝溶液的原因是 。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。