网址:http://m.1010jiajiao.com/timu_id_153229[举报]
第一部分 选择题 (共63分)
1
2
3
4
5
6
7
8
9
B
C
D
D
C
B
A
A
C
10
11
12
13
14
15
16
17
18
C
AD
B
C
B
C
AC
BD
AD
第二部分 非选择题 (共87分)
19.(10分)(1)Mn2++2NH3+CO2+H2O=2NH4++MnCO3↓(2分)
(2)NH3、CO2 (2分) 不需要(2分)
(3)Mn2+(2分) 450(2分)
20.(12分) (l)假设2 :溶液中存在SO32―和HCO3―( 1分)
假设3、溶液中存在HCO3―和SO42―(2和3顺序不限。)(1分)
(2)(10分)
步骤编号
实验操作
预期现象和结论
①
用胶头滴管取少量溶液加入试管A中,再用滴管取过量的lmol/L氯化钡溶液并滴入其中,充分反应后,静置,然后过滤,将沉淀和滤液分别装入另外的两个试管B,C中(3分)
产生白色沉淀,说明原溶液中含有SO42―或SO32―或两者都有(1分)
②
往装有沉淀的试管B中加入过量的2mol/L盐酸,
将产生的气体通入品红溶液(2分)
沉淀部分溶解, 并产生气体.
品红褪色,说明原溶液中一定含有SO42―和SO32―(1分)
③
往装有滤液的试管C中加入2mol/L盐酸;
或加入澄清石灰水(2分)
出现无色气泡,
澄清溶液变浑浊,说明原溶液中含有HCO3―(1分)
④
其它方案合理给分
21(12分)(1)SO2+NaOH=NaHSO3 (1分) HSO3-+H+==SO2+H2O (1分)
(2) AB (2分) 实验时间和加入盐酸酸化的氯化钡溶液后生成沉淀的质量 (2分)
(3)变废为肥,充分利用资源,降低污染 (2分)
(4)+4 (2分)
(5)5CH3OH+6NO3--+6H+ ==5CO2+3N2+13H2O (2分)
22.(10分)⑴MgCl2(熔融)  Mg+Cl2↑
(2分) ⑵Na2S (1分)
Mg+Cl2↑
(2分) ⑵Na2S (1分)
⑶①CO32-+H2O HCO3-+OH-(或2H2SO4)或 HCO3-+H2O
HCO3-+OH-(或2H2SO4)或 HCO3-+H2O H2CO3 +OH- (2分)
H2CO3 +OH- (2分)
②降低含硫烟气的温度(或减小含硫烟气的流速)(2分)
③2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42- (2分)
中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染。(1分)
23.(12分)
⑴.氢氧化钠(或氢氧化钾) (1分)
SO2+2OH?=SO32-+H2O (2分)
2SO32-+O2=2SO42? (2分)
⑵.使SO32-完全氧化为SO42? (2分)
⑶. (或其它合理答案) (2分)
(或其它合理答案) (2分)
⑷.250 mL容量瓶 (1分)
⑸.不合理,会使所测得的铁元素的质量分数偏大(或其它合理答案)(2分)
24.(12分)(1)错误!不能通过编辑域代码创建对象。 (2分)
 (2)9.52 %
(2分)
(2)9.52 %
(2分)
(3)如图所示[注:只要起点在横坐标轴(0,2),
平衡点在横坐标0点后t0前、纵坐标0.2处的示意
图均给分)(4分)
(4)减小 (2分)>(2分)
 25(9分)
25(9分)

26.(1)羟基 羧基 (2分)
错误!不能通过编辑域代码创建对象。 (2分)
(2)
错误!不能通过编辑域代码创建对象。(2分)
(3)A C D (2分)
(4) 错误!不能通过编辑域代码创建对象。 错误!不能通过编辑域代码创建对象。 (2分)
27.⑴分子 (1分) 1s2s22p63s23p63d84s2或[Ar]3d84s2 (2分)
⑵ACD (2分)
⑶①、③、④ (2分)平面三角 (1分)
⑷LaNi5或Ni5La (2分)
(1)为什么较多的余酸不再与铜片继续反应?简述理由:________________。可以证明有余酸的实验方案是__________(填字母)。
a.再加入铁粉 b.再滴入BaCl2溶液 c.再加入银 d.再滴入Na2CO3溶液
(2)甲同学设计求余酸浓度的实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是
________(填字母)。
a.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称量
b.将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、 干燥、称量沉淀
c.用排水法测定其产生气体的体积(折算成标准状况)
d.用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况)
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量。在反应后的溶液中加蒸馏水稀释至100 mL,加入足量Na2S溶液,充分反应后,过滤、洗涤、干燥、称量沉淀。请写出生成沉淀的离子方程式: ___________________________。
(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是________。
(5)丙同学提出甲、乙两同学的实验方案较复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤、干燥、称量。若称得剩余铜片的质量为W g,测得反应后溶液的体积为V mL,请计算剩余硫酸的物质的量浓度=________mol/L(用含W、V的代数式表示)。
已知一氯甲烷,也叫甲基氯,常温下是无色气体,密度为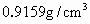 ,熔点为
,熔点为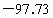 ℃,沸点为
℃,沸点为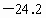 ℃,
℃,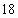 ℃时在水中的溶解度为280mL/L(水),与乙醚、丙酮或苯互溶,能溶于乙醇.
℃时在水中的溶解度为280mL/L(水),与乙醚、丙酮或苯互溶,能溶于乙醇.
某课外学习小组欲在实验室里用如图所示装置制备一氯甲烷:
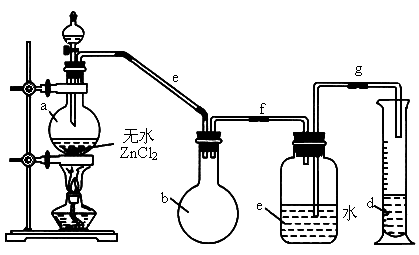
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸,无水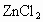 作催化剂.试回答:
作催化剂.试回答:
(1)写出一氯甲烷的电子式:___________.
(2)制备一氯甲烷的化学方程式:___________.
(3)装置b称为___________.
(4)如何检查该套装置的气密性?
(5)实验中实际将甲醇和浓盐酸按物质的量之比为1∶2放入反应器的理由是___________________.
(6)实验结束后,d中收集到的液体中除水外还会含有的物质是___________.(填化学式)
(7)已知,一氯甲烷燃烧时的火焰呈蓝绿色.请在图示装置的基础上加以改进,以检验一氯甲烷燃烧时的现象.写出改进装置的设计方法.
查看习题详情和答案>> 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4?XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量
②下面是其中一次实验的数据
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
(3)装置乙的作用是:
(4)下列说法正确的是:
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气.
(1)请写出铜跟浓硫酸反应的化学方程式:
| ||
| ||
可以证明有余酸的实验方案是
(a)再加入铁粉(b)再滴入BaCl2溶液(c)再加入银(d)再滴入Na2CO3溶液
(2)甲学生设计求余酸浓度的实验方案是测定产生气体的量.其方法有多种,请问下列方案中不可行的是
(a)将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量.
(b)将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
(c)用排水法测定其产生气体的体积(折算成标准状况).
(d)用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况).
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量.在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤.洗涤.干燥、称量沉淀.请写出生成沉淀的离子方程式:
(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是
(5)丙同学提出甲、乙两同学的实验方案设计的复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤.干燥.称量.若称得剩余铜片的质量为Wg,测得反应后溶液的体积为Vml,请计算剩余硫酸的物质的量浓度=
| 0.36-(12.8-w)/32 |
| V×1×10 -3 |
| 0.36-(12.8-w)/32 |
| V×1×10 -3 |