网址:http://m.1010jiajiao.com/timu_id_144018[举报]
9.C 10.B 11.A 12.A 13.D 14.D 15.C
28 (13分)
(1) HNO3 NH3 .files/image024.gif) H2O NH4NO3 (3分)
H2O NH4NO3 (3分)
(2)2Al+2OH- +6H2O=====2[Al(OH)4]- +3H2 Ó 或2Al+2OH- +2H2O====2AlO2- +3H2Ó(2分);
(3)I.<(2分) II K1/K2;66.67%(4分)
(4)N2+8H+ +6e- =======2NH4+(2分)
29.(15分)
(1)①NaNO2(2分);0.8(2分 ) ②b、c(2分 )
(2)①Fe3+>Cu2++>Fe2+(2分)
②方案:将铜棒与碳棒用导线连接,再插入氯化铁溶液,发现有电流产生(3分)
(3)①Cu2+、Fe2+(2分)
②1.0.files/image026.gif) 10-17(mol
10-17(mol.files/image024.gif) L-1)3(2分)
L-1)3(2分)
30(14分)
(1) C(2分)
(2) 避免 Na2SO3==== Na2S+ 2 Na2SO4(2分)
(3)
4 Na2SO3.files/image029.gif) 3
Na2SO4(2分)
3
Na2SO4(2分)
(4)
实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO2-3,的溶液的碱性强,pH增大(2分);S2-+H2O.files/image009.gif) HS-+HO-(2分)
HS-+HO-(2分)
(5)
取 ③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-(或向其中加新制氯水,如有浑浊出现,则证明有S2-)(2分),另取③中溶液适量于试管中,加入HCL酸化的BaCL2溶液,如有白色沉淀 证明SO2-4.files/image031.gif) 38(8分)
38(8分)
31.(8分)
(1) 苯环,醛基(1分);
(2) D(1分)
(3)
.files/image032.gif)
(4)4分(2分)
(21分)(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/LH2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃ (t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=__________(填表达式,不用化简);若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”);若将稀硫酸换成浓硫酸来做该实验,测得的△H_______(填“偏大”、“偏小”或“相同”)。
(2)某高能化学物质N2H2内,氮元素的杂化类型为____,电子式为____,一个分子中有σ键 个 ,π 键 个。
(3).在密闭容器中进行可逆反应: CO(g)+NO2(g)CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通人CO2气体,平衡 移动,反应混合物的颜色 。若通人N2气体,平衡 移动,反应混合物的颜色 。③加入催化剂,平衡 移动。
(4)下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
| 物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1 367 |
①从热量角度分析,目前最适合家庭使用的优质气体燃料是________。
②写出管道煤气中的一氧化碳燃烧热的热化学方程式_______________________
③充分燃烧1mol表中各种燃料,排放出二氧化碳的量最多的是________。
④矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有________等。
查看习题详情和答案>>
在某个容积为2 L的密闭容器内,在T1℃时按下图1所示发生反应:
mA(g)+nB(g)  pD(g)+qE(s),DH<0(m、n、p、q为最简比例的整数)。
pD(g)+qE(s),DH<0(m、n、p、q为最简比例的整数)。
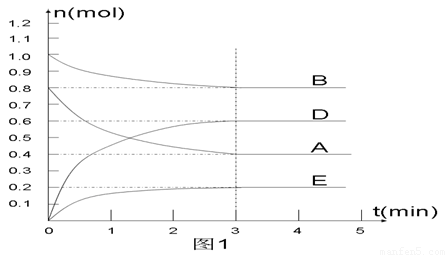
(1)据图1所示,反应开始至达到平衡时,用D表示该反应速率为_____________;
(2)该反应的化学平衡常数K的表达式为________________________________;
(3) 下列措施能增大B的转化率的是 ( )
A.升高温度
B.保持体积不变通入1molB
C.保持体积不变移出部分物质D(g)
D.将容器的容积增大为原来2倍
E. 保持体积不变通入1mol A
(4) 反应开始时向容器中通入一定量的A和B,反应达到平衡时,测得D的浓度为0.6 mol.L-1 。(图2中纵坐标为D的浓度)
①请用实线在下图坐标系中该表示平衡的建立过程。
②若该反应在T2℃(T2> T1)温度下进行,请用虚线画出该平衡的建立过程。
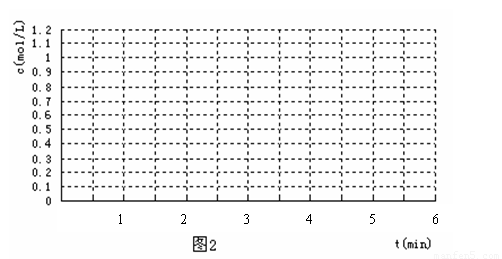
查看习题详情和答案>>
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。T1℃时,将9
mol CO2和12 mol H2充入3 L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是( )
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是( )

A.曲线II对应的条件改变是增大压强
B.T2℃时,上述反应平衡常数为0.42,则T2>T1
C.在T1℃,若起始时向容器中充入 5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g), 则达平衡前v(正)>v(逆)
D.在T1℃,若起始时向容器中充入4.5 molCO2、6mol H2 ,平衡时容器内压强p=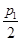
查看习题详情和答案>>



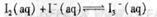
 某I2、KI混合溶液中,
某I2、KI混合溶液中,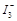 的物质的量浓度c(
的物质的量浓度c(
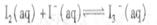 的△H>0
的△H>0