网址:http://m.1010jiajiao.com/timu_id_14107[举报]
一、选择题:1.B 2.D 3.A 4.A 5.B 6.C 7.B 8.A 9.D 10.C
二、选择题:11.B 12.BD 13.CD 14.BD 15.A 16.BD
三、填空、简答和计算
18.(1)0.045mol/L; (2)35.6, 0.045mol/l
19.小于。设98%H2SO4溶液的密度为d1,浓度为C1;49%H2SO4密度为d2,浓度为C2。分别将质量分数转化为物质的量浓度,可得关系C1=10d1, C2=5d2,则C1:C2=2 d1/d2,由于硫酸溶液浓度越大密度越大,所以C1/C2>2,即C2< C1/2=9.2mol/L.
20.(1)2.1,250,量筒、烧杯、玻璃棒、胶头滴管。(2)B、C、A、F、E、D(3)保证溶质全部转入容量瓶。容量瓶盛放热溶液时,体积不准。(4)浓度偏低;偏低;偏高。(5)宣告实验失败,洗净容量瓶后重新配制;宣告实验失败,洗净容量瓶后重新配制。
21.解:设所加硫酸溶液中含有1molH2SO4,则加入氯化钡溶液中产生BaSO4的物质的量也为1mol,质量为
硫酸的质量分数= ×100%=42.06%
×100%=42.06%
硫酸的物质的量的浓度= =5.49(摩/升)
=5.49(摩/升)
答:该硫酸溶液的质量分数是42.06%,物质的量浓度为5.49摩/升。
22.解:
其体积在标准状况下为12.0mol×
 -12.0 mol×
-12.0 mol×
其体积为
 =
= =378
=378
1体积水吸收378体积NH 气(标准状况)
气(标准状况)
若直接列出总式,同样给分:
 =
= =378
=378
答:标准状况,1体积水吸收了378体积NH 气
气
| A.C1=C2 | B.C1>2C2 | C.C1<2C2 | D.C1=2C2 |
A.C1=C2
B.C1>2C2
C.C1<2C2
D.C1=2C2
查看习题详情和答案>>
相同体积的NaCl溶液(浓度为C1)和Na2SO4溶液(浓度为C2),若其中的Na+ 物质的量浓度相同,则它们的物质的量浓度C1和C2的关系是
- A.C1=C2
- B.C1>2C2
- C.C1<2C2
- D.C1=2C2
(1)工业上有一种生产甲醇的反应为:
CO2(g)+3H2(g)CH3OH(g)+H2O(g);△H=-49.0kJ?mol-1
在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 | A | B |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和3mol H2O(g) |
| CH3OH(g)浓度(mol?L-1) | c1 | c2 |
| 反应能量变化 | 放出29.4kJ | 吸收akJ |
②A中达到平衡时CO2的转化率为
某同学设计了一个甲醇燃料电池,并用该电池电解200mL-定浓度NaCl与CuSO4混合溶液,其装置如图:
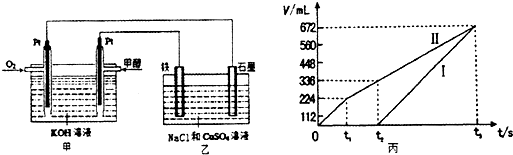
①写出甲中通入甲醇这一极的电极反应式
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式