网址:http://m.1010jiajiao.com/timu_id_13940[举报]
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
D
D
C
D
C
C
B
B
二、选择题
题号
11
12
13
14
15
16
17
18
19
20
答案
D
A
D
C
D
B
D
D
A
C
三、选择题
题号
21
22
23
24
25
26
27
28
29
30
答案
BC
BD
BD
D
B
C
C
A
BC
BD
题号
31
32
33
34
答案
BC
B
AB
D
 四、填空、简答和计算
四、填空、简答和计算
 35. (1)
(2)
35. (1)
(2)
 |
(3)
(4)BaCO3+2H+==Ba2++CO2↑+H2O
 |
 (5)Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
(5)Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
36.(1)Li 原子失去一个电子后, Li+已经形成了稳定结构,此时再失去电子很困难。
(2) C ;(3) ⅢA族,失去第四个电子时所需能量远远大于失去前三个电子所需能量 。
37.(1)产生白色沉淀,试液变成红色;因为在水中SO2和Cl2反应生成盐酸和硫酸,使石蕊试液变红色,硫酸与BaCl2溶液反应产生BaSO4 沉淀。 (2)③、SO3;②、HCl;①、SO2;③、H2O。
38.(14分)(1)碳、氧、钠、硫(2)CO2+2OH-=H2O+CO32-
(3)
 。
。
39.⑴SiO2 Na2SiO3 H2SiO3
⑵

40.(1)
含有SO 或SO
或SO 中的一种或两种都有。
中的一种或两种都有。
(2) BaCO3;(3)
Br-、S2-
; HCO (除SO
(除SO 或SO
或SO 以外)
以外)
41.(1)Al;H2 ;Cl2(2)非金属;
(3)氧化物或氢化物;SiO2+ Si+2CO↑或O2+H2S
Si+2CO↑或O2+H2S 2H2O+S(其它合理答案均可)
2H2O+S(其它合理答案均可)
42.(1) 、
、 ;
; (2)
(2) ;
; 、
、 (3)
(3) 、
、 ;
;
43.解: 0.5molY的离子得到6.02×1023个电子(即1mol电子)被还原为中性原子,所以1molY应得到2mol电子还原为中性原子,即Y离子应带2个带电荷,则其氧化物的化学式应为YO。
YO + 2HCl=YCl2+H2O
(Y+16)g 2mol
∴ =
=
∴Y=24
又∵Y核中质子数等于中子数,∴Y的质子数为12,应是Mg,位于第三周期ⅡA族。
MgO+2H+=Mg2++H2O
44.解:
由方程式可知: =n(被还原的
=n(被还原的 )
)


45. (1)a≤2/3;(2)a≥2; (3) 2/3<a<2, (1?a/2)mol
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为____________,其分子属于______________(填“极性”“非极性”)分子。
(2)E是非金属元素,但能表现出一些金属元素的性质,请写出单质E与氢氧化钠溶液反应的离子方程式_____________________________________________________________________。
(3)一定条件下,A的气体单质与B的气体单质充分反应生成6.
(4)A的单质与c的单质在KOH的浓溶液中可以形成原电池,如果以M和N为惰性电极,在电池的M极通入A气体,N极通入C气体,则N极的电极反应式为____________________。
(5)在
食醋分为酿造醋和配制醋两种。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是______
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol·L-1,则该食醋的总酸量为4.5g/100mL。
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的________ (填写序号)。
a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00mL 0.1000 mol·L-1HCl溶液和20.00mL 0.1000 mol·L-1CH3COOH溶液,得到2条滴定曲线,如下图所示。
①滴定醋酸溶液的曲线是_______ (填“图l”或“图2”);滴定曲线中a=_____ mL;
②E点pH>8的原因用离子方程式表示________。
(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是________(填写序号)
a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸
(5)为标定某醋酸溶液的准确浓度,用0.2000 mol•L-1 的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为________ 。
查看习题详情和答案>>
食醋分为酿造醋和配制醋两种。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是______
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol·L-1,则该食醋的总酸量为4.5g/100mL。
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的________ (填写序号)。
a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00mL 0.1000 mol·L-1HCl溶液和20.00mL 0.1000 mol·L-1CH3COOH溶液,得到2条滴定曲线,如下图所示。
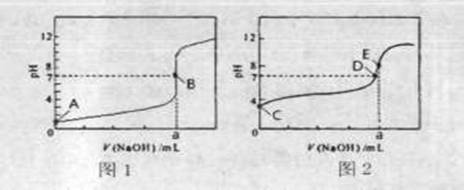
①滴定醋酸溶液的曲线是_______ (填“图l”或“图2”);滴定曲线中a=_____ mL;
②E点pH>8的原因用离子方程式表示________。
(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是________(填写序号)
a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸
(5)为标定某醋酸溶液的准确浓度,用0.2000 mol•L-1 的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
|
实验序号 |
1 |
2 |
3 |
4 |
|
消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为________ 。
查看习题详情和答案>>