摘要: 下列金属或氧化物可以完全溶解的是( )A.1mol Zn与含1mol HCl的稀盐酸共热 B.1mol Cu与含2mol H2SO4的浓硫酸共热C. 1mol Cu与含4mol HNO3的浓硝酸 D.1mol MnO2与含4mol HCl的浓盐酸共热
网址:http://m.1010jiajiao.com/timu_id_135154[举报]
下列金属或氧化物可以完全溶解的是 ................ ( )
![]() A.1mol Zn与含1mol HCl的稀盐酸共热
A.1mol Zn与含1mol HCl的稀盐酸共热
![]() B.1mol Cu与含2mol H2SO4的浓硫酸共热
B.1mol Cu与含2mol H2SO4的浓硫酸共热
![]() C.1mol Cu与含4mol HNO3的浓硝酸
C.1mol Cu与含4mol HNO3的浓硝酸
![]() D.1mol MnO2与含4mol HCl的浓盐酸共热
D.1mol MnO2与含4mol HCl的浓盐酸共热
![]()
下列实验中金属或氧化物可以完全溶解的是 ( )
A.0.1 mol锌片投入到100 mL 1 mol?L-1的盐酸溶液中
B.1 mol MnO2粉末与400 mL10 mol?L-1的盐酸共热
C.常温下1mol铝片投入到200mL18.4mol?L-1硫酸中
D.常温下 1 mol铜片投入含4molHNO3的浓硝酸中
查看习题详情和答案>>下列实验中金属或金属氧化物可以完全溶解的是 ( )
A.1mol铜片与含2 mol H2SO4的浓硫酸共热
B.常温下1 mol铝片投入足量的浓硫酸中
C.1mol MnO2粉末与含2 mol H2O2的溶液共热
D.常温下1 mol铜片投入含4 mol HNO3的浓硝酸中
查看习题详情和答案>>
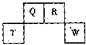 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:(1)T的离子结构示意图为


(2)元素的非金属性为(原子的得电子能力):Q
弱于
弱于
W(填“强于”或“弱于”).(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
S+2H2SO4(浓)
3SO2+2H2O
| ||
S+2H2SO4(浓)
3SO2+2H2O
.
| ||
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
2H2O2
O2↑+2H2O
| ||
2H2O2
O2↑+2H2O
.
| ||
(5)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
NaNO2
NaNO2
I、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子核外电子排布式是
1s22s22p63s23p3
1s22s22p63s23p3
.(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2→6CaSiO3+P4O10 10C+P4O10→P4+10CO
每生成1mol P4时,就有
20
20
mol电子发生转移.II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(1)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3?6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是
分解出HCl气体,抑制CeCl3的水解
分解出HCl气体,抑制CeCl3的水解
.(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
2
2
Ce3++1
1
H2O2+6
6
H2O→2
2
Ce(OH)4↓+6H+
6H+
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.
反应物A的浓度随时间的变化如图所示.
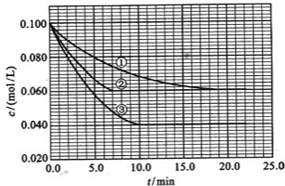
请回答下列问题:
(3)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:②
加催化剂
加催化剂
;达到平衡的时间缩短,平衡时A的浓度未变
达到平衡的时间缩短,平衡时A的浓度未变
.③
温度升高
温度升高
;达到平衡的时间缩短,平衡时A的浓度减小
达到平衡的时间缩短,平衡时A的浓度减小
.(4)实验②平衡时B的转化率为
40%
40%
;实验③平衡时C的浓度为0.06mol/L
0.06mol/L
;(5)该反应是
吸热
吸热
热反应,判断其理由是温度升高,平衡向正反应方向移动
温度升高,平衡向正反应方向移动
;(6)该反应进行到4.0min时的平均反应速度率:
实验②:VB=
0.014mol(L?min)-1
0.014mol(L?min)-1
. 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子).
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol?L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁:向步骤Ⅱ所得溶液中加入过量氨水.
已知:金属离子氢氧化物沉淀所需pH
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)步骤Ⅱ中,可用于调节溶液pH至7~8的最佳试剂是
A
A
(填字母序号).A.MgO B.Na2CO3 C.蒸馏水
(2)Fe2+与H2O2溶液反应的离子方程式为
2Fe2++H2O2+2H+═2Fe3++2H2O
2Fe2++H2O2+2H+═2Fe3++2H2O
.(3)工业上常以Mg2+的转化率为考察指标,确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件.其中,反应温度与Mg2+转化率的关系如右图所示.
①步骤Ⅲ中制备氢氧化镁反应的离子方程式为
Mg2++2NH3?H2O═Mg(OH)2↓+2NH4+
Mg2++2NH3?H2O═Mg(OH)2↓+2NH4+
.②根据图中所示50℃前温度与Mg2+转化率之间 的关系,可判断此反应是
吸热
吸热
(填“吸热”或“放热”)反应.③图中,温度升高至50℃以上Mg2+转化率下降的可能原因是
温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降
温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降
.④Ksp表示沉淀溶解平衡的平衡常数.已知:
Mg(OH)2(s)?Mg2+ (aq)+2OH- (aq) Ksp=c(Mg2+)?c2(OH-)=5.6×10-12
Ca(OH)2(s)?Ca2+ (aq)+2OH- (aq) Ksp=c(Ca2+)?c2(OH-)=4.7×10-6
若用石灰乳替代氨水,
能
能
(填“能”或“不能”)制得氢氧化镁,理由是Mg(OH)2的溶解度小于Ca(OH)2,可发生沉淀的转化
Mg(OH)2的溶解度小于Ca(OH)2,可发生沉淀的转化
.