摘要: ①pH=0的盐酸 ②0.5mol?L-1盐酸 ③0.1mol?L-1的NH4Cl溶液 ④0.1mol?L-1的NaOH溶液 ⑤0.5mol?L-1的NH4Cl溶液.以上溶液中水电离的c(H+)由大到小的顺序是 A. ⑤③④②① B. ①②③⑤④ C. ①②③④⑤ D. ⑤③④①②
网址:http://m.1010jiajiao.com/timu_id_135091[举报]
① pH=0的盐酸 ② 0.5mol?L -1 盐酸 ③ 0.1mol?L -1 的NH 4 Cl溶液 ④ 0.1mol?L -1 的NaOH溶液 ⑤ 0.5mol?L -1 的NH 4 Cl溶液,以上溶液中水电离的 c (H + )由大到小的顺序是( )
A.⑤ ③ ④ ② ① B.① ② ③ ⑤ ④
C.① ② ③ ④ ⑤ D.⑤ ③ ④ ① ②
查看习题详情和答案>>
(1)为了提高生活用水的卫生标准,自来水厂常用Cl2和FeSO4?7H2O(同时使用)进行消毒、净化,以改善水质,其原理是_________。
(2)浓度均为0.1mol/L的下列溶液:①NaHSO4,②H2SO4,③H3PO4,④Al2(SO4)3,⑤Na2CO3,⑥NaHCO3,⑦NaNO3,溶液的pH由小到大的顺序是________。
(3)1×10-5mol?L-1的盐酸溶液稀释1000倍后,该盐酸溶液的pH为___________。 查看习题详情和答案>>
(2)浓度均为0.1mol/L的下列溶液:①NaHSO4,②H2SO4,③H3PO4,④Al2(SO4)3,⑤Na2CO3,⑥NaHCO3,⑦NaNO3,溶液的pH由小到大的顺序是________。
(3)1×10-5mol?L-1的盐酸溶液稀释1000倍后,该盐酸溶液的pH为___________。 查看习题详情和答案>>
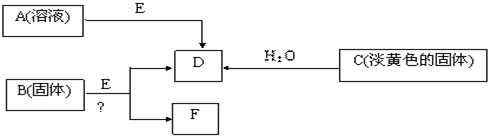
现有短周期元素组成的A、B、C、D、E五种物质,存在如下转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体.

(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol B转移5mol 电子,则B与浓盐酸反应的化学方程式为______. 生成的氧化产物与还原产物的物质的量之比为______;
(2)将F从混合物中分离出来的实验操作步骤为______、______、______.由A制得2mol D时,转移电子数为______ mol
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;______,若将浓度为 c mol?L-1 的M溶液与0.2mol?L-1 的一元酸HA等体积混合,所得溶液pH=7.溶液中离子浓度的大小关系为______ (浓度用C表示).
(4)固体C与FeCl3溶液按物质的量为2:1反应的离子方程式______;
将Fe(OH)3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na2FeO4)的一种方法,请完成下列方程式:
______Fe(OH)3+______NaOH+______NaClO=______Na2FeO4+______NaCl+______H2O.
查看习题详情和答案>>
现有短周期元素组成的A、B、C、D、E五种物质,存在如下转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体.
(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol B转移5mol 电子,则B与浓盐酸反应的化学方程式为______. 生成的氧化产物与还原产物的物质的量之比为______;
(2)将F从混合物中分离出来的实验操作步骤为______、______、______.由A制得2mol D时,转移电子数为______ mol
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;______,若将浓度为 c mol?L-1 的M溶液与0.2mol?L-1 的一元酸HA等体积混合,所得溶液pH=7.溶液中离子浓度的大小关系为______ (浓度用C表示).
(4)固体C与FeCl3溶液按物质的量为2:1反应的离子方程式______;
将Fe(OH)3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na2FeO4)的一种方法,请完成下列方程式:
______Fe(OH)3+______NaOH+______NaClO=______Na2FeO4+______NaCl+______H2O.
查看习题详情和答案>>

(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol B转移5mol 电子,则B与浓盐酸反应的化学方程式为______. 生成的氧化产物与还原产物的物质的量之比为______;
(2)将F从混合物中分离出来的实验操作步骤为______、______、______.由A制得2mol D时,转移电子数为______ mol
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;______,若将浓度为 c mol?L-1 的M溶液与0.2mol?L-1 的一元酸HA等体积混合,所得溶液pH=7.溶液中离子浓度的大小关系为______ (浓度用C表示).
(4)固体C与FeCl3溶液按物质的量为2:1反应的离子方程式______;
将Fe(OH)3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na2FeO4)的一种方法,请完成下列方程式:
______Fe(OH)3+______NaOH+______NaClO=______Na2FeO4+______NaCl+______H2O.
(2011?武胜县一模)现有短周期元素组成的A、B、C、D、E五种物质,存在如下转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体.

(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol B转移5mol 电子,则B与浓盐酸反应的化学方程式为
(2)将F从混合物中分离出来的实验操作步骤为
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;
(4)固体C与FeCl3溶液按物质的量为2:1反应的离子方程式
将Fe(OH)3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na2FeO4)的一种方法,请完成下列方程式:
查看习题详情和答案>>

(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol B转移5mol 电子,则B与浓盐酸反应的化学方程式为
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
. 生成的氧化产物与还原产物的物质的量之比为5:1
5:1
;(2)将F从混合物中分离出来的实验操作步骤为
溶解
溶解
、过滤
过滤
、蒸发
蒸发
.由A制得2mol D时,转移电子数为4
4
mol(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;
2Cl-+2H2O
H2↑+Cl2↑+2OH-
| ||
2Cl-+2H2O
H2↑+Cl2↑+2OH-
,若将浓度为 c mol?L-1 的M溶液与0.2mol?L-1 的一元酸HA等体积混合,所得溶液pH=7.溶液中离子浓度的大小关系为
| ||
c(K+)=c(A-)>c(OH-)=c(H+)
c(K+)=c(A-)>c(OH-)=c(H+)
(浓度用C表示).(4)固体C与FeCl3溶液按物质的量为2:1反应的离子方程式
2Na2O2+Fe3++2H2O=Fe(OH)3↓+4Na++O2↑+OH-
2Na2O2+Fe3++2H2O=Fe(OH)3↓+4Na++O2↑+OH-
;将Fe(OH)3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na2FeO4)的一种方法,请完成下列方程式:
2
2
Fe(OH)3+4
4
NaOH+3
3
NaClO=2
2
Na2FeO4+3
3
NaCl+5
5
H2O.