摘要:56%化学反应速率与化学平衡13选择
网址:http://m.1010jiajiao.com/timu_id_127361[举报]
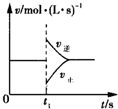 可逆反应2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
可逆反应2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )| A、维持温度、容积不变,t1时充入SO3(g) | B、维持压强不变,t1时升高反应体系温度 | C、维持温度、容积不变,t1时充入一定量Ar | D、维持温度、压强不变,t1时充入SO3(g) |
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
 SiO2(s)+
SiO2(s)+ C(s)+
C(s)+ N2(g)
N2(g)
 Si3N4(s)+
Si3N4(s)+ CO(g)
CO(g)
(1)配平反应中各物质的化学计量数,并标明电子转移方向和数目.
(2)该反应的氧化剂是 ,其还原产物是 .
(3)上述反应进程中能量变化示意图如图1,试在图象中用虚线表示在反应中使用催化剂后能量的变化情况.
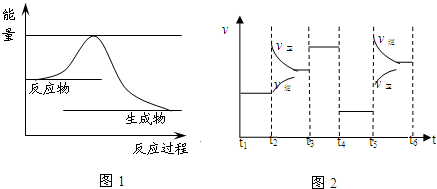
(4)该反应的平衡常数表达式为K= .升高温度,其平衡常数 (选填“增大”、“减小”或“不变”).
(5)该化学反应速率与反应时间的关系如图2所示,t2时引起v正突变、v逆渐变的原因是 ,t3引起变化的因素为 ,t5时引起v逆大变化、v正小变化的原因是 .
查看习题详情和答案>>
 SiO2(s)+
SiO2(s)+ C(s)+
C(s)+ N2(g)
N2(g)| 高温 |
 Si3N4(s)+
Si3N4(s)+ CO(g)
CO(g)(1)配平反应中各物质的化学计量数,并标明电子转移方向和数目.
(2)该反应的氧化剂是
(3)上述反应进程中能量变化示意图如图1,试在图象中用虚线表示在反应中使用催化剂后能量的变化情况.

(4)该反应的平衡常数表达式为K=
(5)该化学反应速率与反应时间的关系如图2所示,t2时引起v正突变、v逆渐变的原因是
(2009?湛江二模)在某个容积为2.0L的密闭容器中,在T℃时按下图1所示发生反应:
mA(g)+nB(g) pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
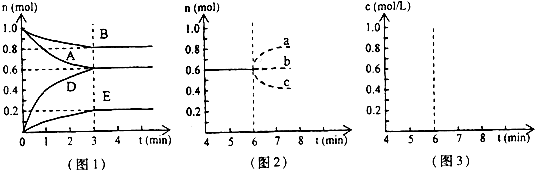
(1)图1所示,反应开始至达到平衡时,用D表示的平均反应速率为
(2)T℃时该反应的化学平衡常数K的数值为
(3)反应达到平衡后,第6min时:
①若升高温度,D的物质的量变化曲线最可能的是
②若在6min时仍为原平衡,此时将容器的容积压缩为原来的一半.请在图3中画出6min后B浓度的变化曲线
 .
.
4)在T℃时,相同容器中,若开始时加入0.4molA、0.8molB、0.9molD和0.5molE0.5mol,反应达到平衡后,A的浓度范围为
(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
查看习题详情和答案>>
mA(g)+nB(g)
 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
(1)图1所示,反应开始至达到平衡时,用D表示的平均反应速率为
0.1mol/(L?min)
0.1mol/(L?min)
.(2)T℃时该反应的化学平衡常数K的数值为
0.75
0.75
.(3)反应达到平衡后,第6min时:
①若升高温度,D的物质的量变化曲线最可能的是
c
c
(用图2中的a~c的编号作答);②若在6min时仍为原平衡,此时将容器的容积压缩为原来的一半.请在图3中画出6min后B浓度的变化曲线


4)在T℃时,相同容器中,若开始时加入0.4molA、0.8molB、0.9molD和0.5molE0.5mol,反应达到平衡后,A的浓度范围为
0.2mol/L<c(A)<0.3mol/L
0.2mol/L<c(A)<0.3mol/L
.(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
BD
BD
.A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
 通过实验测定反应速率的方法有多种,为证明化学反应速率与反应的浓度有关.有同学设计如下实验:
通过实验测定反应速率的方法有多种,为证明化学反应速率与反应的浓度有关.有同学设计如下实验:(1)比较锌粒与不同浓度硫酸反应时的速率,如图装置可通过测定收集等体积H2需要的
时间
时间
来实现;(2)在KMnO4与H2C2O4反应中,可通过测定
溶液褪色所需时间
溶液褪色所需时间
来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应,产生二氧化碳气体、水和Mn2+的离子反应方程式:2MnO4-+5H2C2O4 +6H+=2Mn2++8H2O+10CO2↑
2MnO4-+5H2C2O4 +6H+=2Mn2++8H2O+10CO2↑
;此反应开始反应缓慢,随后反应迅速加快,其原因是C
C
(填字母)A.KMnO4溶液中的H+起催化作用
B.生成的CO2逸出,使生成物浓度降低
C. 反应中,生成的Mn2+起催化作用
D.在酸性条件下KMnO4的氧化性增强
(3)在Na2S2O3和H2SO4反应中,该反应速率可通过测定
出现浑浊所需的时间
出现浑浊所需的时间
来测定,分析下列实验数据记录,可推测出现混浊的时间由快到慢的顺序是t1=t4<t3<t2
t1=t4<t3<t2
;| 序号 | Na2S2O3溶液 | 稀H2SO4 | 出现混浊时间 | ||
| 浓度 | 用量 | 浓度 | 用量 | ||
| (1) | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 10mL | t1 |
| (2) | 0.1mol?L-1 | 10mL+5mL 水 | 0.1mol?L-1 | 10mL | t2 |
| (3) | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 5mL+5mL水 | t3 |
| (4) | 0.1mol?L-1 | 5mL | 0.1mol?L-1 | 5mL | t4 |
(已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色.)往上述溶液中加入氢氧化钠溶液呈
黄色
黄色
色;向已加入氢氧化钠的溶液中,再加入过量硫酸溶液呈橙红色
橙红色
色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着减弱
减弱
这种改变的方向移动.