网址:http://m.1010jiajiao.com/timu_id_108572[举报]
一、选择题:(共30分)
一
题号
1
2
3
4
5
6
7
8
答案
D
D
D
B
B
C
C
D
题号
9
10
11
12
13
14
15
答案
A
B
C
B
C
C
A
二、填空题:(共30分)
16、(2分)2PbO?PbO2 ,Pb2(PbO4)或Pb(PbO2)2
17、(3分)CO+PdCl2+H2O==2HCl+Pd+CO2;还原。
18、(3分)(1)燃烧产物中存在CO2;⑵存在;中的澄清石灰水变浑浊。
19、(2分)将肥皂水分别逐滴滴入这四种待测溶液并振荡,根据肥皂水滴入后开始产生泡沫时的不同滴数来区分 。
20、(2分)挥发出来的HCl进入石灰水,与Ca(OH)2作用而阻碍了CO2与Ca(OH)2的作用 (1分) ;CO2与生成的CaCO3作用,生成Ca(HCO3)2 (1分 )。
21、(2分)Si3N4 ;H2SiO3。
22、(6分)⑴用玻璃棒把待测溶液滴在一张pH试纸上,并约一分钟内把试纸显示的颜色跟比色卡对照; ⑵碱;酸。⑶洗发;护发。
23、(6分)
⑴ ① H2S+Na2CO3=NaHCO3+NaHS ;② NaHS+RNO+H2O=S↓+NaOH+RNHOH ;
③ NaOH+Na HCO3=Na2CO3+H2O ;④ 2RNHOH+O2=2RNO+2H2O
⑵ 2H2S+O2=2S↓+2H2O;催化
三、实验题:(共29分)
24、(11分)⑴除去鼓入空气中的二氧化碳;防止空气中的二氧化碳和水进入B中影响实验结果;防止D中的水蒸气进入B中;用除去二氧化碳的空气赶走体系中的二氧化碳;用除去二氧化碳的空气将反应产生的二氧化碳 全部赶入B中; 不能 ,①空气中含少量二氧化碳、②反应后装置中残留二氧化碳均会造成结论偏差。⑵ 43.4 ;95.4% 。
25、(12分) (1) 乙;因为铁是化学性质较活泼的金属,尤其是铁粉颗粒小,常温下更易与空气中的氧气、水蒸气反应而生锈。 (2)
实验步骤
预期的实验现象
结论
①用磁铁充分接触滤纸上的脱氧剂粉末
绝大部分黑色粉末被吸引
脱氧剂的成分是铁粉
②将红色物质放入小试管中,加入足量稀硫酸观察现象。继续滴加足量的NaOH溶液。
红色物质溶解,溶液呈黄棕色,产生红褐色沉淀
红色物质是Fe203
此项可有多种答案,只要原理正确,各项叙述清楚,能确定铁粉及氧化铁的存在,均可给分。
(3) Fe203 + 3H2SO4 = Fe2( SO4 )3十3H2O
Fe2( SO4 )3 + 6NaOH === 2Fe (OH)3↓+3Na2 SO4
26、(6分) 换一根长的导管,并用湿毛巾包住导管,然后再在导管的另一端做点火试验。
⑷导管口同样能点燃,去掉毛巾,导内壁看不到冷凝的固体;
导管口不能点燃,去掉毛巾,导管内壁可看到有冷凝的固体
导管口能点燃,但火焰较小,去掉毛巾,导管内壁能看到冷凝的固体。
⑸2CnH2n+2+(3n+1)O2 点燃 2nCO2+(2n+2) H2O
四、计算题
27、 (l)84.8%,
实验次数
每次产生的CO2的质量(g)
第一次先逐滴加盐酸100g
0
第二次再逐滴加盐酸100g
第三次再逐滴加盐酸100g
②关系图。
.files/image007.gif) CO2
CO2
.files/image008.gif) |
.files/image009.gif)
.files/image010.gif)
.files/image011.gif) 质量/g
质量/g
8.8
0 100 200 300 稀盐酸质量/g
本资料由《七彩教育网》www.7caiedu.cn 提供!
实验原理:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数.
实验装置:
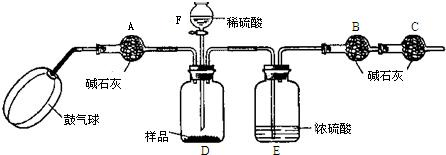
实验步骤:
①如图连接装置(除B、C外)并加入所需药品.
②称量并记录B的质量(m1).(称量时注意封闭B的两端.)
③按动鼓气球,持续约1分钟.
④连接上B、C.
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞.
⑥按动鼓气球,持续约1分钟.
⑦称量并记录B的质量(m2).(称量时注意封闭B的两端及E右端的出口.)
⑧计算.
(1)已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用:
干燥管C的作用是
E装置的作用是
步骤③中鼓气的目的是
步骤⑥中鼓气的目的是
本实验能否同时省略③、⑥两个步骤?
(2)若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL)
〖实验原理〗Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得样品碳酸钠的质量分数.
〖实验装置〗

①如图所示连接装置,并检查气密性
②将10.0g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量为300.0g
④打开分液漏斗中的活塞,往试样溶液中滴入20%的稀硫酸,直至不再产生气泡为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量原盛有碱石灰的U型管的质量
⑦重复步骤⑤和⑥的操作,直至原盛有碱石灰的U型管的质量不再改变,测得质量为303.3g
回答下列问题:
(1)装置中NaOH溶液的作用是
(2)浓硫酸的作用是
(3)从导管A处缓缓鼓入一定量的空气的目的是
(4)B装置的作用是
(5)该样品中碳酸钠的质量分数是
某纯碱样品中含有少量氯化钠,现欲测定其中碳酸钠的质量分数,进行如下实验:
〖实验原理〗Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得样品碳酸钠的质量分数.
〖实验装置〗
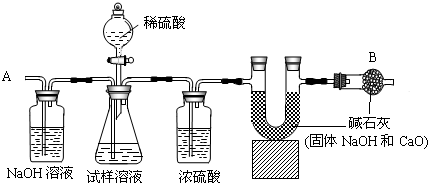
①如图所示连接装置,并检查气密性
②将10.0g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量为300.0g
④打开分液漏斗中的活塞,往试样溶液中滴入20%的稀硫酸,直至不再产生气泡为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量原盛有碱石灰的U型管的质量
⑦重复步骤⑤和⑥的操作,直至原盛有碱石灰的U型管的质量不再改变,测得质量为303.3g
回答下列问题:
(1)装置中NaOH溶液的作用是______,写出该装置中发生反应的化学方程式______.
(2)浓硫酸的作用是______.
(3)从导管A处缓缓鼓入一定量的空气的目的是______;
(4)B装置的作用是______,
(5)该样品中碳酸钠的质量分数是______.
查看习题详情和答案>>
【实验原理】Na2CO3+H2SO4===Na2SO4 + H2O + CO2↑ 通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
【实验装置】
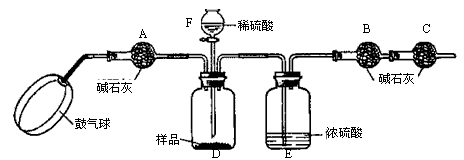
①如图连接装置(除B、C外)并加入所需药品。
②称量并记录B的质量(m1)。(称量时注意封闭B的两端。)
⑧按动鼓气球,持续约1分钟。
④连接上B、C。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口。)
⑧计算。
⑴已知碱石灰的主要成分是氧化钙和氢氧化钠,则干燥管A的作用: ;
干燥管C的作用是 ;
E装置的作用是 。
步骤③中鼓气的目的是 ;
步骤⑥中鼓气的目的是 ;
本实验能否同时省略③、⑥两个步骤? ,原因是 。
⑵若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL) mL,若m1为51.20g,m2为53.18g,样品中碳酸钠的质量分数为 。
实验原理:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数.
实验装置:
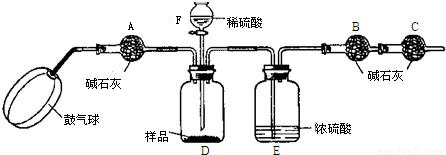
实验步骤:
①如图连接装置(除B、C外)并加入所需药品.
②称量并记录B的质量(m1).(称量时注意封闭B的两端.)
③按动鼓气球,持续约1分钟.
④连接上B、C.
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞.
⑥按动鼓气球,持续约1分钟.
⑦称量并记录B的质量(m2).(称量时注意封闭B的两端及E右端的出口.)
⑧计算.
(1)已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用:______;
干燥管C的作用是______
E装置的作用是______.
步骤③中鼓气的目的是______
步骤⑥中鼓气的目的是______;
本实验能否同时省略③、⑥两个步骤?______,原因是______.
(2)若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL)______mL,若m1为51.20g,m2为53.18g,样品中碳酸钠的质量分数为______.
查看习题详情和答案>>