摘要:21.图 5-16是用一氧化碳还原氧化铜的实验: 图5-16 (1)先通入一氧化碳.过一会儿再给氧化铜加热的理由是 . (2)根据实验事实填表: 观察处 观察到的现象 化学反应方程式 CuO(A) B C (3)在C处点燃处理.其目的是: .
网址:http://m.1010jiajiao.com/timu3_id_99544[举报]
回答下列问题.
(1)如表是某品牌方便面的营养成分,请回答:
从表中所给信息判断该品牌方便面所含的营养素主要有 、蛋白质、油脂、无机盐和水;有些青少年由于摄入维生素不足而引起生长发育迟缓,为增加维生素,建议应该多吃 .
(2)北京奥运“祥云”火炬设计有回热管,即用铝箔将铜棒贴在燃料筒外侧,使火炬上下的热量能够交流,这主要是利用了金属铜的 性.
(3)奥运主火炬的燃料是天然气,其主要成分的化学式为 .火炬燃烧了16天后在15s内熄灭了,熄灭火炬时,为吹熄余火,需向管道内吹入一定量的 (填字母).
A.氧气B.空气C.氮气D.氢气
(4)北京奥运会场馆“鸟巢”的主结构为钢结构.为防止钢铁生锈,可采取的方法之一是 ;工业上冶炼铁的原理之一是用一氧化碳还原氧化铁,该反应的化学方程式为 .
查看习题详情和答案>>
(1)如表是某品牌方便面的营养成分,请回答:
| 方便面营养成分表(每100g中含量) | ||||||||
| 糖类(g) | 脂肪(g) | 蛋白质(g) | 水分(g) | 钠(mg) | 钾(mg) | 磷(mg) | 钙(mg) | 其他 |
| 61.6 | 21.1 | 9.5 | 3.6 | 1144 | 134 | 80 | 25 | … |
(2)北京奥运“祥云”火炬设计有回热管,即用铝箔将铜棒贴在燃料筒外侧,使火炬上下的热量能够交流,这主要是利用了金属铜的
(3)奥运主火炬的燃料是天然气,其主要成分的化学式为
A.氧气B.空气C.氮气D.氢气
(4)北京奥运会场馆“鸟巢”的主结构为钢结构.为防止钢铁生锈,可采取的方法之一是
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
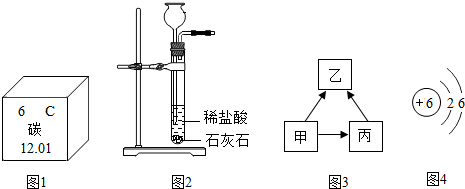
(1)碳元素的化学性质与其原子的
(2)图1为元素周期表中的一格,下列说法不正确的是
A.碳元素属于非金属元素
B.碳原子核内质子数为6
C.碳元素的原子结构示意图为图4
D.碳的相对原子质量为12.01g
(3)写出图2装置中所发生反应的化学方程式为
(4)甲、乙、丙都是常见含有碳元素的物质,它们之间有如图3所示的转化关系(部分物质和反应条件已略去).其中甲和丙都可以作燃料,乙和丙中所含的元素种类相同.乙能引起“温室效应”,则乙的化学式为
(5)工业上用一氧化碳还原氧化铁炼铁.现用50t含80%氧化铁的赤铁矿石最多能冶炼出多少吨铁?
查看习题详情和答案>>

(1)碳元素的化学性质与其原子的
最外层电子数
最外层电子数
关系密切.(2)图1为元素周期表中的一格,下列说法不正确的是
D
D
(填标号).A.碳元素属于非金属元素
B.碳原子核内质子数为6
C.碳元素的原子结构示意图为图4
D.碳的相对原子质量为12.01g
(3)写出图2装置中所发生反应的化学方程式为
CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
;实验室确定气体发生装置时应考虑的因素是反应物的状态和反应条件等
反应物的状态和反应条件等
;检查该装置的气密性的方法是:将该装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到漏斗颈中形成一段稳定的水柱(或液面不再下降)
漏斗颈中形成一段稳定的水柱(或液面不再下降)
现象,即可证明装置不漏气.(4)甲、乙、丙都是常见含有碳元素的物质,它们之间有如图3所示的转化关系(部分物质和反应条件已略去).其中甲和丙都可以作燃料,乙和丙中所含的元素种类相同.乙能引起“温室效应”,则乙的化学式为
CO2
CO2
;甲转化为乙的途径有多种,写出通过置换反应的方式甲转化为乙的化学方程式为2Fe2O3+3C
4Fe+3CO2↑
| ||
2Fe2O3+3C
4Fe+3CO2↑
.从微观的角度解释乙、丙性质有差异的原因是
| ||
两种物质的分子构成不同
两种物质的分子构成不同
.(5)工业上用一氧化碳还原氧化铁炼铁.现用50t含80%氧化铁的赤铁矿石最多能冶炼出多少吨铁?
图1是实验室常用的装置,请回答下列问题:
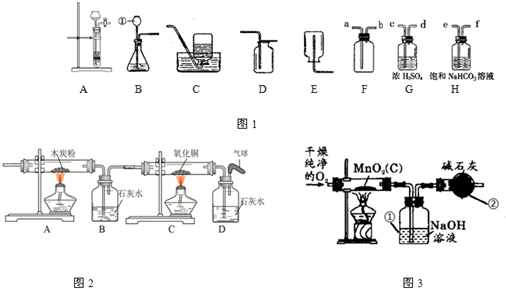
(1)写出仪器①的名称
(2)实验室制备并收集氧气的装置组合是
(3)实验室制得的CO2气体中常含有HCl和水蒸气,为了得到纯净、干燥的CO2气体,除杂装置的导管气流方向连接顺序是
A.c→d→e→f B.d→c→e→f C.e→f→c→d D.f→e→d→c
(4)将氧气通入如图2所示的装置,实验中观察到B中澄清石灰水变浑浊,C中黑色固体变为红色,则进入装置B的气体一定含有
(5)实验室制取氧气时常用二氧化锰作催化剂.某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计的实验方案是:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定.
①如图3所示是用干燥纯净的氧气与样品反应来测定二氧化锰质量分数的装置,仪器②中装有碱石灰(氧化钙和氢氧化钠的混合物),其作用是
②为验证装置①已将CO2吸收完全,可在装置①与②之间加入
③现称取5.0g二氧化锰样品进行实验,装置①反应前后的质量差为1.1g,则样品中二氧化锰的质量分数为多少?(写出计算过程)
查看习题详情和答案>>

(1)写出仪器①的名称
长颈漏斗
长颈漏斗
.收集某气体能采用E装置,由此推测该气体具有的性质是密度比空气小
密度比空气小
.(2)实验室制备并收集氧气的装置组合是
A(或B)C(或D)
A(或B)C(或D)
(填装置序号),反应的化学方程式为2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;若用F装置收集该气体,则气体应从
| ||
a
a
端进入(填“a”或“b”);装置A、B都可以用来制取二氧化碳,比较这两个装置,指出A装置的一个突出优点是可以随时控制反应的发生和停止
可以随时控制反应的发生和停止
.(3)实验室制得的CO2气体中常含有HCl和水蒸气,为了得到纯净、干燥的CO2气体,除杂装置的导管气流方向连接顺序是
C
C
(填选项字母编号).A.c→d→e→f B.d→c→e→f C.e→f→c→d D.f→e→d→c
(4)将氧气通入如图2所示的装置,实验中观察到B中澄清石灰水变浑浊,C中黑色固体变为红色,则进入装置B的气体一定含有
一氧化碳和二氧化碳
一氧化碳和二氧化碳
,B处发生反应的化学方程式是CO2+Ca(OH)2═CaCO3↓+H2O
CO2+Ca(OH)2═CaCO3↓+H2O
.(5)实验室制取氧气时常用二氧化锰作催化剂.某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计的实验方案是:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定.
①如图3所示是用干燥纯净的氧气与样品反应来测定二氧化锰质量分数的装置,仪器②中装有碱石灰(氧化钙和氢氧化钠的混合物),其作用是
吸收空气中的二氧化碳
吸收空气中的二氧化碳
.②为验证装置①已将CO2吸收完全,可在装置①与②之间加入
盛有澄清石灰水的洗气瓶
盛有澄清石灰水的洗气瓶
装置进行证明.③现称取5.0g二氧化锰样品进行实验,装置①反应前后的质量差为1.1g,则样品中二氧化锰的质量分数为多少?(写出计算过程)
(2013?金山区一模)小明同学想研究一氧化碳的还原性,通过查阅资料知道:草酸(H2C2O4)与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4
CO↑+CO2↑+H2O,于是他设计了如图的实验装置,结合装置回答下列问题:?

(1)图A方框中是用草酸制取CO的反应装置,你认为应选择
(2)A装置中产生的气体经过B、C装置(除去杂质),进入D装置的是纯净的CO气体,实验开始时,要先
(3)装置D中反应的化学方程式为
(4)为检验装置D中产生的气体,E装置中的液体应为
(5)装置F中酒精灯的作用是
查看习题详情和答案>>
| ||
| △ |

(1)图A方框中是用草酸制取CO的反应装置,你认为应选择
甲
甲
(填“甲”、“乙”或“丙”)装置;(2)A装置中产生的气体经过B、C装置(除去杂质),进入D装置的是纯净的CO气体,实验开始时,要先
通一段时间CO气体
通一段时间CO气体
,然后加热氧化铁
加热氧化铁
,其目的是排尽空气,防止爆炸;实验结束时,为了防止生成的铁被空气氧化
生成的铁被空气氧化
,要注意先停止加热,继续通一氧化碳直到冷却.(3)装置D中反应的化学方程式为
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
;
| ||
(4)为检验装置D中产生的气体,E装置中的液体应为
澄清的石灰水
澄清的石灰水
,化学反应方程式为CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
;(5)装置F中酒精灯的作用是
点燃一氧化碳气体,防止污染空气
点燃一氧化碳气体,防止污染空气
.碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容。
(1)碳元素的化学性质与其原子的 关系密切。
(2)下图为元素周期表中的一格,下列说法不正确的是 (填标号)。

(3)写出下图装置中所发生反应的化学方程式为 ;实验室确定气体发生装置时应考虑的因素是 ;检查该装置的气密性的方法是:将该装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到 现象,即可证明装置不漏气。

(4)甲、乙、丙都是常见含有碳元素的物质,它们之间有如右图所示的转化关系(部分物质和反应条件已略去)。其中甲和丙都可以作燃料,乙和丙中所含的元素种类相同。乙能引起“温室效应”,则乙的化学式为 ;甲转化为乙的途径有多种,写出通过置换反应的方式甲转化为乙的化学方程式为 。从微观的角度解释乙、丙性质有差异的原因是 。

(5)工业上用一氧化碳还原氧化铁炼铁。现用50t含80%氧化铁的赤铁矿石最多能冶炼出
多少吨铁?
(1)碳元素的化学性质与其原子的 关系密切。
(2)下图为元素周期表中的一格,下列说法不正确的是 (填标号)。

| A.碳元素属于非金属元素 |
| B.碳原子核内质子数为6 |
C.碳元素的原子结构示意图为 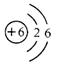 |
| D.碳的相对原子质量为12.01g |

(4)甲、乙、丙都是常见含有碳元素的物质,它们之间有如右图所示的转化关系(部分物质和反应条件已略去)。其中甲和丙都可以作燃料,乙和丙中所含的元素种类相同。乙能引起“温室效应”,则乙的化学式为 ;甲转化为乙的途径有多种,写出通过置换反应的方式甲转化为乙的化学方程式为 。从微观的角度解释乙、丙性质有差异的原因是 。

(5)工业上用一氧化碳还原氧化铁炼铁。现用50t含80%氧化铁的赤铁矿石最多能冶炼出
多少吨铁?