摘要:9.二氧化硫的含量是空气质量监测的指标之一.请你参与兴趣小组对二氧化硫部分性质的实验探究. (1)正常的雨水略显 性.用化学方程式表示其中的原因 . 若雨水的PH小于 .表明空气受到了污染.为了测定二氧化硫水溶液的PH.小明同学向一个集满二氧化硫气体的的质地较软的塑料瓶中加入适量的水.立即旋紧瓶塞.振荡.使二氧化硫充分溶解(二氧化硫溶于水形成亚硫酸).你能观察到的现象可能是 .打开瓶塞.测定瓶中二氧化硫水溶液PH的实验操作是 (2)为了探究二氧化硫能否与氢氧化钠反应. SO2气体 小宁同学用如图所示的装置进行实验 发现试管内的液面上升.小宁同学由此得到结论: 二氧化硫能与氢氧化钠反应.你认为小宁 同学由上述实验得出的结论是否合理? NaOH . 溶液 理由是 . (3)兴趣小组同学取刚降到热电厂附近的雨水进行测定.每隔五分钟测一次PH.其数据如下: 测定时间 5:05 5:10 5:15 5:20 5:25 5:30 5:35 PH 4.95 4.94 4.94 4.88 4.86 485 4.85 分析上述数据变化.你可以得出的结论是 , 针对此结论.你猜想其中的原因为 .
网址:http://m.1010jiajiao.com/timu3_id_98679[举报]
二氧化硫(SO2)的含量是空气质量监测的指标之一。请你参与兴趣小组对二氧化硫部分性质的实验探究。

(1)若雨水的pH小于5.6,表明空气受到污染。为了测定二氧化硫水溶液的pH,小明同学向一个集满二氧化硫气体的质地较软的塑料瓶中加入适量的水,立即旋紧瓶盖,振荡,使二氧化硫充分溶解(二氧化硫能与水反应形成亚硫酸),打开瓶塞,测定瓶中二氧化硫水溶液pH的实验操作是
(2)为了探究二氧化硫能否与氢氧化钠反应,小宁同学用右图所示装置进行实验,发现试管内液面上升。小宁同学由此得到结论:二氧化硫能与氢氧化钠反应。你认为小宁同学由上述实验得出的结论是否合理? (填“是”或“否”),理由是
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 | 5:35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
分析上述数据变化,你可以得出的结论是:
针对此结论,你猜测其中的原因为 。结合大理石被酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸酸性由强到弱的顺序为 .
查看习题详情和答案>>空气是一种宝贵的自然资源.
(1)对空气的成分:①氧气 ②氮气 ③稀有气体 ④二氧化碳及其它气体和杂质.
按体积计算,由多到少的排列顺序正确的是
A.①②③④B.②①③④C.①②④③D.②①④③
(2)下列事实说明空气中含有哪些成分(填名称)
酒精在空气中可以燃烧说明空气中含有
酥脆的饼干露置于空气中变软说明空气中含有
澄清的石灰水在空气中放置,其表面生成一层白膜说明空气中含有
能够供给呼吸的
(3)目前我国对城市空气质量监测项目中,一般不考虑的是
A.二氧化碳 B.二氧化氮 C.二氧化硫 D.可吸入颗粒物.
查看习题详情和答案>>
(1)对空气的成分:①氧气 ②氮气 ③稀有气体 ④二氧化碳及其它气体和杂质.
按体积计算,由多到少的排列顺序正确的是
B
B
A.①②③④B.②①③④C.①②④③D.②①④③
(2)下列事实说明空气中含有哪些成分(填名称)
酒精在空气中可以燃烧说明空气中含有
氧气
氧气
酥脆的饼干露置于空气中变软说明空气中含有
水蒸气
水蒸气
澄清的石灰水在空气中放置,其表面生成一层白膜说明空气中含有
二氧化碳
二氧化碳
能够供给呼吸的
氧气
氧气
(3)目前我国对城市空气质量监测项目中,一般不考虑的是
A
A
A.二氧化碳 B.二氧化氮 C.二氧化硫 D.可吸入颗粒物.
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标.某兴趣小组同学收集某地的雨水进行实验.
【相关信息】①每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
②SO2能使品红溶液褪色;
③pH<5.6的雨水为酸雨;
④海水呈弱碱性;
⑤BaSO3不溶于水,能与盐酸反应;BaSO4不溶于水,也不溶于盐酸.
【分析讨论】①正常雨水的pH范围是:7>pH>5.6,偏酸性,这是因为 .
②酸雨能腐蚀金属制品,从基本反应类型上看主要反应属于 .
③收集的酸雨样品放置一段时间后pH减小,原因是SO2与水反应生成的H2SO3被氧化为H2SO4.试写出该反应的化学方程式 .
【提出猜想】同学们对刚收集到的酸雨样品中的溶质进行猜想:
猜想Ⅰ:酸雨中溶质只含有H2SO3;
猜想Ⅱ:酸雨中溶质只含有H2SO4;
猜想Ⅲ:酸雨中溶质 .
【实验探究】
(1)向刚收集的酸雨样品中滴加过量Ba(OH)2溶液,有白色沉淀生成,过滤.
①在滤液中滴加 溶液,溶液呈 色.证明在酸雨样品中滴加的Ba(OH)2溶液已过量.
②向沉淀中加入足量盐酸,沉淀部分溶解且放出有刺激性气味气体.该反应的化学方程式为 ,根此现象有关酸雨中溶质的猜想 正确.
(2)某同学取酸雨样品V L,加入17.1%的Ba(OH)2溶液至不再产生沉淀时,恰好消耗10.00g Ba(OH)2溶液.该V L酸雨样品中溶解SO2的质量为 .
实验反思:在某些酸雨中还可分析出有硝酸存在,这是由于空气中含有某元素+4价氧化物的原因,这种氧化物的化学式为 .
拓展延伸:利用海水脱硫是减少SO2排放的有效方法,其工艺流程如下图所示:
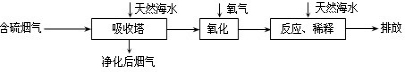
天然海水吸收了较多的含硫烟气后,有H2SO3生成,H2SO3与海水中的离子反应,会释放出CO2,通入氧气后氧化后,海水的酸性显著增强.
①设计一种检验净化后的烟气中是否含SO2的简单的实验方案: .
②氧化后的海水需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 .
查看习题详情和答案>>
【相关信息】①每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
③pH<5.6的雨水为酸雨;
④海水呈弱碱性;
⑤BaSO3不溶于水,能与盐酸反应;BaSO4不溶于水,也不溶于盐酸.
【分析讨论】①正常雨水的pH范围是:7>pH>5.6,偏酸性,这是因为
②酸雨能腐蚀金属制品,从基本反应类型上看主要反应属于
③收集的酸雨样品放置一段时间后pH减小,原因是SO2与水反应生成的H2SO3被氧化为H2SO4.试写出该反应的化学方程式
【提出猜想】同学们对刚收集到的酸雨样品中的溶质进行猜想:
猜想Ⅰ:酸雨中溶质只含有H2SO3;
猜想Ⅱ:酸雨中溶质只含有H2SO4;
猜想Ⅲ:酸雨中溶质
【实验探究】
(1)向刚收集的酸雨样品中滴加过量Ba(OH)2溶液,有白色沉淀生成,过滤.
①在滤液中滴加
②向沉淀中加入足量盐酸,沉淀部分溶解且放出有刺激性气味气体.该反应的化学方程式为
(2)某同学取酸雨样品V L,加入17.1%的Ba(OH)2溶液至不再产生沉淀时,恰好消耗10.00g Ba(OH)2溶液.该V L酸雨样品中溶解SO2的质量为
实验反思:在某些酸雨中还可分析出有硝酸存在,这是由于空气中含有某元素+4价氧化物的原因,这种氧化物的化学式为
拓展延伸:利用海水脱硫是减少SO2排放的有效方法,其工艺流程如下图所示:

天然海水吸收了较多的含硫烟气后,有H2SO3生成,H2SO3与海水中的离子反应,会释放出CO2,通入氧气后氧化后,海水的酸性显著增强.
①设计一种检验净化后的烟气中是否含SO2的简单的实验方案:
②氧化后的海水需要用大量的天然海水与之混合后才能排放,该操作的主要目的是
人类每时每刻都离不开空气,没有空气就没有生命,也就没有生机勃勃的地球.
(1)空气主要由
(2)空气中的各种成分广泛应用于多个领域,其中氧气可用于
A.制造霓虹灯B.医疗急救
(3)为了保护空气,在我国新颁布的《环境空气质量标准》中,基本监测项目增设了PM2.5,浓度限值,与该监测项目有关的是
A.二氧化硫B.二氧化氮C.一氧化碳D.可吸入颗粒物.
查看习题详情和答案>>
(1)空气主要由
氮气
氮气
(填物质名称)和氧气组成,此外,还含有少量的稀有气体等.(2)空气中的各种成分广泛应用于多个领域,其中氧气可用于
B
B
(填字母序号,下同),稀有气体可用于A
A
.A.制造霓虹灯B.医疗急救
(3)为了保护空气,在我国新颁布的《环境空气质量标准》中,基本监测项目增设了PM2.5,浓度限值,与该监测项目有关的是
D
D
(填字母序号).A.二氧化硫B.二氧化氮C.一氧化碳D.可吸入颗粒物.
2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM2.5监测指标.PM2.5是指大气中直径小于或等于2.5微米的颗粒物.雾霾空气中含有大量的( )
| A、二氧化碳 | B、一氧化碳 | C、二氧化硫 | D、可吸入颗粒物 |