摘要:48.[05汕头课改]粗盐中含有钙离子.硫酸根离子和泥沙等杂质.实验室中粗盐提纯的操作步骤如下: (1)将粗盐研细.加水使其充分溶解.然后过滤得到滤液.粗盐研细的目的是---------------.过滤是为了除去-------------------------. (2)向上述滤液中加入过量的BaCl2溶液.直至沉淀不再产生.则加入过量的BaCl2溶液的目的是------------. (3)继续加入过量的---------溶液.直至沉淀不再产生.然后过滤.得到滤液和沉淀.沉淀的成分是 -----------------------.-------------------------------. (5)将上述溶液蒸发结晶.得到精盐.蒸发时玻璃棒要不断搅拌.直到-----------------------时停止加热.
网址:http://m.1010jiajiao.com/timu3_id_96322[举报]
海水是一种重要的自然资源.以下是我市对海水资源的部分利用.
(1)从海水中获取淡水.常用的操作方法是 .
(2)从海水中获得氯化钠.将海水进行 可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,-有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤.正确的操作顺序是 .(用序号填一种合理组合).
(3)从海水中得到金属镁.下图是从海水中提取镁的简单流程.
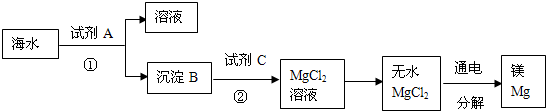
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ,由无水MgCl2制取Mg的化学方程式为 .海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:
.
(4)海水“制碱”.下图是海水“制碱”的部分简单流程.
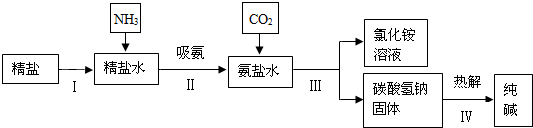
步骤Ⅲ、步骤Ⅳ反应的化学方程式为: 、 .
制氨盐水的过程中要先通入氨气,再通入二氧化碳.如果反过来,二氧化碳的吸收率会降低.这是因为 .
查看习题详情和答案>>
(1)从海水中获取淡水.常用的操作方法是
(2)从海水中获得氯化钠.将海水进行
(3)从海水中得到金属镁.下图是从海水中提取镁的简单流程.

上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为
(4)海水“制碱”.下图是海水“制碱”的部分简单流程.

步骤Ⅲ、步骤Ⅳ反应的化学方程式为:
制氨盐水的过程中要先通入氨气,再通入二氧化碳.如果反过来,二氧化碳的吸收率会降低.这是因为
(2013?莱芜)化学是研究物质组成、结构、性质及其变化规律的基础自然科学,请回答:
(1)从组成角度看:氯化钠是由
(2)从微粒角度看:氯化钠是由
(3)从制备角度看:将海水进行
(4)从变化角度看:将氯化钠和水在通电条件下反应能生成一种碱、氢气和氯气(CI2),该反应的化学方程式为
查看习题详情和答案>>
(1)从组成角度看:氯化钠是由
钠元素和氯元素
钠元素和氯元素
组成.(2)从微粒角度看:氯化钠是由
Na+、Cl-
Na+、Cl-
构成(用微粒符号表示).(3)从制备角度看:将海水进行
蒸发结晶
蒸发结晶
可得到粗盐.除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,常加入过量的①Na2CO3溶液、②BaCI2溶液、③NaOH溶液,三种试剂的加入顺序为②③①或③②①或②①③
②③①或③②①或②①③
(填序号).碳酸钠和盐酸反应液能生成氯化钠,工业上不用此反应制备氯化钠的原因是碳酸钠、盐酸的成本比氯化钠高
碳酸钠、盐酸的成本比氯化钠高
.(4)从变化角度看:将氯化钠和水在通电条件下反应能生成一种碱、氢气和氯气(CI2),该反应的化学方程式为
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
| ||
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
.高中化学反应分为两类,一类是有元素的化合价升降的化学反应是氧化还原反应,另一类是反应前后元素化合价都没有改变的是非氧化还原反应,据此判断上述反应的类型为
| ||
氧化还原反应
氧化还原反应
.湿地之都,水绿盐城!
(1)新四军纪念馆是盐城市的名片之一.馆内有许多抗战时的枪炮,但有些表面出现锈迹,其主要原因是:铁与
(2)郭猛的温泉度假村是人们休闲的好去处.
①温泉水富含钾、钙、镁、氟、硅等,这里的“钾、钙、镁、氟、硅”指的是.
A.分子 B.原子 C.元素 D.单质
②温泉水的pH在7.5~8.9之间,该温泉水显
③检验该温泉水是硬水还是软水的简单方法是
(3)新建的龙冈盐龙湖是一项重大的惠民工程,将为盐城人民提供优质水源.现在自来水的生产过程如图1所示.
①下列属于自来水生产使用的净水方法是
A.沉淀 B.过滤 C.煮沸 D.蒸馏
②自来水可用氯气杀菌消毒.请将下列化学方程式补充完整:Cl2+H2O=HClO+
③能否用硝酸银区分盐城的自来水和蒸馏水
(4)盐城是一座以“盐”命名的城市,有着独特、深远的海盐文化,有着丰富的海水资源.以下是我市对海水资源的部分利用.
①从海水中获得氯化钠.将海水进行
②粗盐可以用过溶解、
③粗盐中含有的:CaSO4、MgCl2等可溶性杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤.正确的操作顺序是
A、①⑤②③④⑦⑥B、①③②⑤④⑦⑥C、①③②⑤⑦④⑥
④氯化钠除食用外还是一种化工产品,如工业上利用氯化钠和水在通电条件下生成烧碱、氢气和氯气.请写出该反应的化学方程式

⑤从海水中得到金属镁.图2是从海水中提取镁的简单流程.
上述过程中,试剂A为熟石灰,则沉淀B为
查看习题详情和答案>>
(1)新四军纪念馆是盐城市的名片之一.馆内有许多抗战时的枪炮,但有些表面出现锈迹,其主要原因是:铁与
氧气
氧气
、水
水
等物质共同作用的结果.(2)郭猛的温泉度假村是人们休闲的好去处.
①温泉水富含钾、钙、镁、氟、硅等,这里的“钾、钙、镁、氟、硅”指的是.
C
C
(填标号)A.分子 B.原子 C.元素 D.单质
②温泉水的pH在7.5~8.9之间,该温泉水显
碱性
碱性
(填“酸性”、“碱性”或“中性”).③检验该温泉水是硬水还是软水的简单方法是
取样,加入肥皂水,搅拌后观察现象
取样,加入肥皂水,搅拌后观察现象
.(3)新建的龙冈盐龙湖是一项重大的惠民工程,将为盐城人民提供优质水源.现在自来水的生产过程如图1所示.
①下列属于自来水生产使用的净水方法是
AB
AB
.(填标号)A.沉淀 B.过滤 C.煮沸 D.蒸馏
②自来水可用氯气杀菌消毒.请将下列化学方程式补充完整:Cl2+H2O=HClO+
HCl
HCl
.③能否用硝酸银区分盐城的自来水和蒸馏水
不能
不能
.(填“能”或“不能”)(4)盐城是一座以“盐”命名的城市,有着独特、深远的海盐文化,有着丰富的海水资源.以下是我市对海水资源的部分利用.
①从海水中获得氯化钠.将海水进行
蒸发
蒸发
可得到粗盐②粗盐可以用过溶解、
过滤
过滤
、蒸发等操作除去其中的难溶性杂质如泥沙.③粗盐中含有的:CaSO4、MgCl2等可溶性杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤.正确的操作顺序是
C
C
.(用序号填空)A、①⑤②③④⑦⑥B、①③②⑤④⑦⑥C、①③②⑤⑦④⑥
④氯化钠除食用外还是一种化工产品,如工业上利用氯化钠和水在通电条件下生成烧碱、氢气和氯气.请写出该反应的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||

⑤从海水中得到金属镁.图2是从海水中提取镁的简单流程.
上述过程中,试剂A为熟石灰,则沉淀B为
Mg(OH)2
Mg(OH)2
.请写出沉淀B与试剂C 发生的反应的化学方程式Mg(OH)2+2HCl=MgCl2+2H2O
Mg(OH)2+2HCl=MgCl2+2H2O
. 24、3月22日是“世界水日”.2009年“世界水日”的宣传主题为:“跨界水--共享的水、共享的机遇”.水与人类的生活和生产密切相关.请回答以下相关问题:
24、3月22日是“世界水日”.2009年“世界水日”的宣传主题为:“跨界水--共享的水、共享的机遇”.水与人类的生活和生产密切相关.请回答以下相关问题:(1)如图,是一种探究水的组成的装置,该实验的结论是
水是有氢元素和氧元素组成的
.(2)冬天在汽车的水箱中加入少量的乙二醇,可防止水结冰,这是因为:
乙二醇能降低水的凝固点
.(3)从海水中可获得粗盐,为进一步除去粗盐中含有的Na2SO4、CaCl2等杂质,可进行下列操作:①加过量的BaCl2溶液;②溶解③过滤;④蒸发结晶;⑤加适量的盐酸;⑥加过量的Na2CO3溶液.其合理的操作顺序是
②①⑥③⑤④
(每步操作只能用一次).其中加入过量Na2CO3溶液的目的是除去氯化钙和过剩的氯化钡
.(2012?花都区一模)海水是一种重要的自然资源,以下是我市对海水资源的部分利用.
(1)从海水中获得氯化钠.将海水进行
(2)从海水中得到金属镁.下图是从海水中提取镁的简单流程.

上述过程中,沉淀B与稀盐酸发生的是中和反应,则沉淀B的化学式为
无水MgCl2通电分解生成Mg和另一种气体,该反应的化学方程式为:
查看习题详情和答案>>
(1)从海水中获得氯化钠.将海水进行
蒸发
蒸发
可得到粗盐;为除去粗盐中含有的Na2SO4、CaCl2、MgCl2等杂质,其中加入BaCl2溶液除去的物质是Na2SO4
Na2SO4
;加入NaOH溶液除去的物质是MgCl2
MgCl2
.(2)从海水中得到金属镁.下图是从海水中提取镁的简单流程.

上述过程中,沉淀B与稀盐酸发生的是中和反应,则沉淀B的化学式为
Mg(OH)2
Mg(OH)2
.无水MgCl2通电分解生成Mg和另一种气体,该反应的化学方程式为:
MgCl2
Mg+Cl2↑
| ||
MgCl2
Mg+Cl2↑
.
| ||