摘要:19.合乎实际.并应用到工业生产中的是------- A 通电分解水 B 高温下用CO把Fe从它的氧化物中还原出来. C 用工业酒精勾兑白酒 D 高温煅烧石灰石专门制造CO2. 20现榨的苹果汁.在空气中有淡绿色变为棕黄色.你猜测的原因是-------( ) A苹果汁中Fe2+的变成Fe3+ B 苹果汁中含有Cu2+ C苹果汁中含有OH- D苹果汁中含有Na+
网址:http://m.1010jiajiao.com/timu3_id_95835[举报]
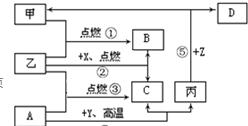 27、右图是初中化学中常见物质间的转化关系,其中甲、乙为气态单质,丙为固态单质;A、B、C均为氧化物,常温下B为液态.化合物D的水溶液呈浅绿色.
27、右图是初中化学中常见物质间的转化关系,其中甲、乙为气态单质,丙为固态单质;A、B、C均为氧化物,常温下B为液态.化合物D的水溶液呈浅绿色.(1)写出有关物质的化学式:A
CO
、XCH4
;(2)指出反应 ④在生产实际中的应用:
工业上冶炼(生)铁
(举一例说明);(3)将A、C两种氧化物区别开来,可使用的一种溶液为
澄清石灰水(Ba(OH)2或紫色石蕊试液)
(填名称);(4)写出反应 ⑤的化学方程式:
Fe+H2SO4=FeSO4+H2↑(或Fe+2HCl=FeCl2+H2↑)
.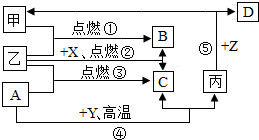 如图是初中化学中常见物质间的转化关系,其中甲、乙为气态单质,丙为固态单质;A、B、C均为氧化物,常温下B为液态.化合物D的水溶液呈浅绿色.
如图是初中化学中常见物质间的转化关系,其中甲、乙为气态单质,丙为固态单质;A、B、C均为氧化物,常温下B为液态.化合物D的水溶液呈浅绿色.(1)写出有关物质的化学式:A
CO
CO
,BH2O
H2O
.(2)指出反应④在实际生产中的应用:
工业上冶炼(生)铁
工业上冶炼(生)铁
(举一例说明).(3)A、C两种氧化物化学性质不同的原因是
分子的构成不同
分子的构成不同
,将它们区别开来,可使用的一种溶液为澄清石灰水
澄清石灰水
(填名称).(4)写出反应⑤的化学方程式:
Fe+H2SO4═FeSO4+H2↑(或Fe+2HCl═FeCl2+H2↑)
Fe+H2SO4═FeSO4+H2↑(或Fe+2HCl═FeCl2+H2↑)
.
工业生产中,多数金属的冶炼过程都是采用热还原法.为测定某三氧化钨粉末中三氧化钨的质量分数,春蕾化学课外活动小组的同学根据此原理,采用如图所示装置进行实验.
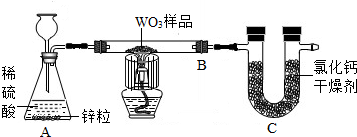
已知实验用三氧化钨样品的质量为13.0g.其中WO3反应完全,化学方程式为:WO3+3H2
W+3H2O,而样品中的杂质不参加反应;C中吸收完全.该小组经过规范的实验操作后得到了两组数据,记录如下表
(1)中反应的化学方程式为: ;
(2)任选一组数据,计算样品中 WO3的质量分数(精确到0.1%),写出必要的计算过程,并对结果的可靠性进行评价.若不可靠,说明原因. 查看习题详情和答案>>

已知实验用三氧化钨样品的质量为13.0g.其中WO3反应完全,化学方程式为:WO3+3H2
| ||
| 实验前 | 实验后 | |
| B装置的总质量/g | 45.5 | 43.1 |
| C装置的总质量/g | 100.5 | 103.3 |
(2)任选一组数据,计算样品中 WO3的质量分数(精确到0.1%),写出必要的计算过程,并对结果的可靠性进行评价.若不可靠,说明原因. 查看习题详情和答案>>
不少科学家认为地球表面变暖及一些异常气候(如年初发生在我国南方部分地区的雪灾)与大气中二氧化碳的含量增加所形成的“温室效应”有一定的关系.
(1)试分析判断,下列现象会加剧“温室效应”的是 (填序号).
①汽车尾气排放②工业废气排放③植物光合作用④石油燃烧⑤喷洒农药
(2)大海和小军在老师指导下,制取并对二氧化碳性质进行探究,下图是实验室制取二氧化碳和验证_二氧化碳性质的仪器:
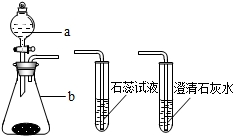
①仪器a是 ,仪器b是 ,实验室用于制取二氧化碳的药品是 和稀盐酸,反应原理的表达式为 ;
②实验室的稀盐酸正好用完,小军想到使用浓盐酸加少量水稀释成稀盐酸.当他打开浓盐酸的瓶塞,看到瓶口冒出了白雾.查阅资料得知:浓盐酸具有挥发性,其中溶解的HCl气体挥发到空气中,形成盐酸小雾滴.
③大海取了两支试管,分别倒入3mL蒸馏水和滴加相同滴数的紫色石蕊试液,并编号为A、B试管,在A试管中通入生成的二氧化碳,观察到的现象是 ,这是因为 ;B试管不通入二氧化碳的目的是 .
④小军将制得的气体直接通入澄清石灰水,却未发现任何明显的变化,小军仔细思考后,用学过的化学知识解释了其中的原因:
⑤小海用导管向澄清石灰水中吹气,观察到 ,反应的表达式为: ;老师让小海继续向试管中吹气,过一段时间后,发现沉淀消失又变成澄清溶液.为了知道沉淀消失的原因,小海上网搜索到相关资料:
碳酸钙能与水和二氧化碳反应,生成易溶于水的碳酸氢钙,反应表达式: ;
碳酸氢钙不稳定,加热后可分解为碳酸钙、水和二氧化碳.请尝试写出生成碳酸氢钙及其受热分解的反应表达式:
(3)在农业生产中,二氧化碳可以作为温室肥料,促进植物的光
合作用,提高农作物的产量;在工业生产中,二氧化碳和氨气还可以在高温高压条件下生成一种高效的氮肥尿素,其氮元素的质量分数是 ,某工厂需要生产300吨尿素,至少需要二氧化碳 吨.制得的尿素样品测得含氮元素质量分数为44.8% (杂质不含氮元素),化肥中所含尿素的质量分数为 .
查看习题详情和答案>>
(1)试分析判断,下列现象会加剧“温室效应”的是
①汽车尾气排放②工业废气排放③植物光合作用④石油燃烧⑤喷洒农药
(2)大海和小军在老师指导下,制取并对二氧化碳性质进行探究,下图是实验室制取二氧化碳和验证_二氧化碳性质的仪器:

①仪器a是
②实验室的稀盐酸正好用完,小军想到使用浓盐酸加少量水稀释成稀盐酸.当他打开浓盐酸的瓶塞,看到瓶口冒出了白雾.查阅资料得知:浓盐酸具有挥发性,其中溶解的HCl气体挥发到空气中,形成盐酸小雾滴.
③大海取了两支试管,分别倒入3mL蒸馏水和滴加相同滴数的紫色石蕊试液,并编号为A、B试管,在A试管中通入生成的二氧化碳,观察到的现象是
④小军将制得的气体直接通入澄清石灰水,却未发现任何明显的变化,小军仔细思考后,用学过的化学知识解释了其中的原因:
⑤小海用导管向澄清石灰水中吹气,观察到
碳酸钙能与水和二氧化碳反应,生成易溶于水的碳酸氢钙,反应表达式:
碳酸氢钙不稳定,加热后可分解为碳酸钙、水和二氧化碳.请尝试写出生成碳酸氢钙及其受热分解的反应表达式:
(3)在农业生产中,二氧化碳可以作为温室肥料,促进植物的光
合作用,提高农作物的产量;在工业生产中,二氧化碳和氨气还可以在高温高压条件下生成一种高效的氮肥尿素,其氮元素的质量分数是
(2013?柳州二模)硫酸是柳州市的一种重要工业产品,下图是工业采用接触法生产硫酸的工艺流程图

(1)从硫酸厂的生产流程中不难发现,吸收塔中SO2不可能是100%吸收,所以尾气必须处理,否则含大量SO2的尾气会造成环境的污染,最大的危害是形成
①杜绝用煤做燃料;②把工厂的烟囱加高;③用烧碱溶液吸收后再排放;④开发新能源; ⑤研究经济高效的回收SO2的技术.
(2)沸腾炉中发生的主要反应是4FeS2+11O2高温2R+8SO2,推断炉渣的主要成分R的化学式是
(3)为了提高硫铁矿(主要成份是FeS2)的利用率,在工业生产中,需要将硫铁矿粉碎后再进行生产的原因是什么?
(4)写出接触室发生的反应的化学方程式并指出其所属的基本反应类型
(5)为了提高硫酸的利用率,吸收塔选用9%的浓硫酸来吸收,写出吸收塔内发生的反应的化学方程式
(6)若将100g质量分数为98%的浓硫酸稀释为10%的稀硫酸需加水
(7)浓硫酸具有强烈腐蚀性,生产时每个工人必须严格按照规程进行操作,如果不慎将少量的浓硫酸沾到皮肤或衣服上,你的处理方法是什么?
查看习题详情和答案>>

(1)从硫酸厂的生产流程中不难发现,吸收塔中SO2不可能是100%吸收,所以尾气必须处理,否则含大量SO2的尾气会造成环境的污染,最大的危害是形成
酸雨
酸雨
;为了减少这种污染,对此生产流程可采取的措施是③④⑤
③④⑤
(选填下列做法的序号).①杜绝用煤做燃料;②把工厂的烟囱加高;③用烧碱溶液吸收后再排放;④开发新能源; ⑤研究经济高效的回收SO2的技术.
(2)沸腾炉中发生的主要反应是4FeS2+11O2高温2R+8SO2,推断炉渣的主要成分R的化学式是
Fe203
Fe203
(3)为了提高硫铁矿(主要成份是FeS2)的利用率,在工业生产中,需要将硫铁矿粉碎后再进行生产的原因是什么?
(4)写出接触室发生的反应的化学方程式并指出其所属的基本反应类型
(5)为了提高硫酸的利用率,吸收塔选用9%的浓硫酸来吸收,写出吸收塔内发生的反应的化学方程式
(6)若将100g质量分数为98%的浓硫酸稀释为10%的稀硫酸需加水
880
880
g.(7)浓硫酸具有强烈腐蚀性,生产时每个工人必须严格按照规程进行操作,如果不慎将少量的浓硫酸沾到皮肤或衣服上,你的处理方法是什么?