摘要:某同学为了研究实验室中用某氯酸钾样品制氧气的有关问题,他将5g该样品与1g二氧化锰混合,加热该混合物,在不同时间测得有关数据如下表: 加热时间 t1 t2 t3 t4 剩余固体质量/g 5.04 / 4.08 / 生成氧气的质量/g / 1.84 / 1.92 ⑴加热t3时间后氯酸钾是否已经完全反应? 是 .此时二氧化锰的质量为 1 g.
网址:http://m.1010jiajiao.com/timu3_id_95745[举报]
实验室常用H2O2和MnO2的混合物来制取氧气,写出该反应的化学方程式 .
某化学兴趣小组的同学,已经知道MnO2在氯酸钾分解的反应中也起催化剂的作用,他们想研究氧化铁能否在该反应中起同样的作用,于是他们对该问题进行了探究.
(一)通过查阅有关资料得到以下信息:
(1)氧化铁是一种难溶于水的红棕色固体;氯酸钾和氯化钾都是极易溶于水的固体.
(2)氧化铁可以与稀盐酸反应,得到棕黄色的氯化铁溶液,这是氧化铁的化学性质之一.
(二)实验报告:
(三)结论:氧化铁在氯酸钾分解的反应中也起到催化剂的作用.
查看习题详情和答案>>
某化学兴趣小组的同学,已经知道MnO2在氯酸钾分解的反应中也起催化剂的作用,他们想研究氧化铁能否在该反应中起同样的作用,于是他们对该问题进行了探究.
(一)通过查阅有关资料得到以下信息:
(1)氧化铁是一种难溶于水的红棕色固体;氯酸钾和氯化钾都是极易溶于水的固体.
(2)氧化铁可以与稀盐酸反应,得到棕黄色的氯化铁溶液,这是氧化铁的化学性质之一.
(二)实验报告:
| 实验步骤 | 简答 |
| (1)称取12.25克KClO3,加热至O2不再产生为止,用去20分钟,得到4.8克O2. | 写出方程式 |
| (2)取A克氧化铁加热,没有得到O2. | 氧化铁的化学式为 |
| 实验步骤 | 简答 |
| (3)将12.25克KClO3和A克氧化铁 混合物,加热至O2不再产生为止,用去8分钟,得到4.8克O2. | 反应中氧化铁的作用是 |
| (4)将步骤(3)试管内残余的固体进行分离,主要操作步骤有 |
可知反应前后氧化铁的 |
| (5)再将步骤(4)得到的氧化铁放入盛有足量稀盐酸的烧杯里,发现氧化铁消失,逐渐形成棕黄色溶液. | 实验说明分离后得到的氧化铁的 |
实验室常用下列装置研究气体的制取和性质,根据所学知识回答下列问题.
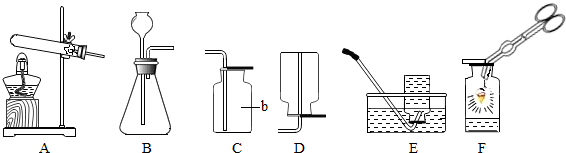
(1)写出实验室制取氧气的一个文字表达式
(2)用C装置收集氧气的依据是
(3)按图F作细铁丝在氧气中燃烧的实验时,瓶底放少量水或铺一层细沙的原因是
(4)低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种.请回答:
①苹果酸钠盐的相对分子质量是
②苹果酸钠盐中各元素的质量比为mC:mH:mO:mNa=
③若某病人每天食用5.85g苹果酸钠盐,比食用相同质量的食盐(NaCl)少摄入钠元素多少克?(计算结果保留一位小数)
查看习题详情和答案>>

(1)写出实验室制取氧气的一个文字表达式
高锰酸钾
锰酸钾+二氧化锰+氧气或氯酸钾
氯化钾+氧气或过氧化氢
水+氧气
| 加热 |
| 二氧化锰 |
| 加热 |
| 二氧化锰 |
高锰酸钾
锰酸钾+二氧化锰+氧气或氯酸钾
氯化钾+氧气或过氧化氢
水+氧气
,利用该反应制取氧气,发生装置应选| 加热 |
| 二氧化锰 |
| 加热 |
| 二氧化锰 |
A或A或B
A或A或B
(填序号).(2)用C装置收集氧气的依据是
氧气的密度比空气的密度大
氧气的密度比空气的密度大
,检验氧气是否集满的方法是将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了
将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了
.(3)按图F作细铁丝在氧气中燃烧的实验时,瓶底放少量水或铺一层细沙的原因是
防止熔化物溅落,炸裂瓶底
防止熔化物溅落,炸裂瓶底
.(4)低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种.请回答:
①苹果酸钠盐的相对分子质量是
156
156
.②苹果酸钠盐中各元素的质量比为mC:mH:mO:mNa=
48:5:80:23
48:5:80:23
.③若某病人每天食用5.85g苹果酸钠盐,比食用相同质量的食盐(NaCl)少摄入钠元素多少克?(计算结果保留一位小数)
实验室常用下列装置来制取气体:
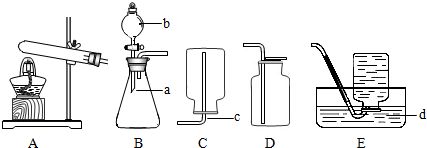
(1)写出图中标号仪器的名称:a
(2)装置B中使用仪器b具有的优点是
(3)用双氧水和二氧化锰来制取氧气时,应选用的发生装置是
(4)实验室若用高锰酸钾来制备氧气,则应选用的发生装置是
(5)上述两种方法都能用于实验室制备氧气,你认为其中相对较好的方法是
(6)实验室常用氯化铵固体与碱石灰固体共热来制取氨气.常温下氨气是一种无色、有刺激性气味的气体,密度比空气小,氨气极易溶于水.制取氨气反应的文字表达式:氯化铵+熟石灰 氯化钙+氨气+水.则制取并收集氨气,应该从上图中选择的发生装置是(
(6)“化学反应条件的控制是实验的灵魂”.某校化学兴趣小组在老师指导下,进行了“影响双氧水(过氧化氢溶液)分解因素”的探究实验.下表是该化学兴趣小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2溶液制取150mL氧气所需的时间(秒)
请你分析回答:
①该研究小组在设计方案时.考虑了浓度、
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
查看习题详情和答案>>

(1)写出图中标号仪器的名称:a
锥形瓶
锥形瓶
b分液漏斗
分液漏斗
;c导管
导管
;d水槽
水槽
;(2)装置B中使用仪器b具有的优点是
反应随开随关
反应随开随关
;若要检查该装置的气密性,应如何操作在导管上接乳胶管并用弹簧夹夹紧,向分液漏斗内不断加水,一段时间后分液漏斗内液面不在下降,则气密性良好
在导管上接乳胶管并用弹簧夹夹紧,向分液漏斗内不断加水,一段时间后分液漏斗内液面不在下降,则气密性良好
.(3)用双氧水和二氧化锰来制取氧气时,应选用的发生装置是
B
B
(填序号),该反应的符号表达式为:2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,二氧化锰是该反应的
| ||
催化剂
催化剂
.(4)实验室若用高锰酸钾来制备氧气,则应选用的发生装置是
A
A
(填序号),该反应的符号表达式为2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
;此反应中二氧化锰是作为
| ||
生成物
生成物
.要获得干燥的氧气,应选用的收集装置是D
D
.(5)上述两种方法都能用于实验室制备氧气,你认为其中相对较好的方法是
用双氧水和二氧化锰来制取氧气
用双氧水和二氧化锰来制取氧气
,其理由是不需加热,操作简便
不需加热,操作简便
.(6)实验室常用氯化铵固体与碱石灰固体共热来制取氨气.常温下氨气是一种无色、有刺激性气味的气体,密度比空气小,氨气极易溶于水.制取氨气反应的文字表达式:氯化铵+熟石灰 氯化钙+氨气+水.则制取并收集氨气,应该从上图中选择的发生装置是(
A
A
(填序号,下同),收集装置是C
C
.(6)“化学反应条件的控制是实验的灵魂”.某校化学兴趣小组在老师指导下,进行了“影响双氧水(过氧化氢溶液)分解因素”的探究实验.下表是该化学兴趣小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2溶液制取150mL氧气所需的时间(秒)
| 反应条件\浓度 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
①该研究小组在设计方案时.考虑了浓度、
温度
温度
、催化剂
催化剂
等因素对过氧化氢分解速率的影响.②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
温度越高,过氧化氢的分解速率越快(或过氧化氢浓度越高,过氧化氢的分解速率越快或使用催化剂,过氧化氢的分解速率越快)
温度越高,过氧化氢的分解速率越快(或过氧化氢浓度越高,过氧化氢的分解速率越快或使用催化剂,过氧化氢的分解速率越快)
.实验室常用H2O2和MnO2的混合物来制取氧气,写出该反应的化学方程式________.
某化学兴趣小组的同学,已经知道MnO2在氯酸钾分解的反应中也起催化剂的作用,他们想研究氧化铁能否在该反应中起同样的作用,于是他们对该问题进行了探究.
(一)通过查阅有关资料得到以下信息:
(1)氧化铁是一种难溶于水的红棕色固体;氯酸钾和氯化钾都是极易溶于水的固体.
(2)氧化铁可以与稀盐酸反应,得到棕黄色的氯化铁溶液,这是氧化铁的化学性质之一.
(二)实验报告:
| 实验步骤 | 简答 |
| (1)称取12.25克KClO3,加热至O2不再产生为止,用去20分钟,得到4.8克O2. | 写出方程式________ |
| (2)取A克氧化铁加热,没有得到O2. | 氧化铁的化学式为________ |
| 实验步骤 | 简答 |
| (3)将12.25克KClO3和A克氧化铁 混合物,加热至O2不再产生为止,用去8分钟,得到4.8克O2. | 反应中氧化铁的作用是________,生成氧气的质量为________. |
| (4)将步骤(3)试管内残余的固体进行分离,主要操作步骤有________、________和________.得到氧化铁的质量为________克. | 可知反应前后氧化铁的________保持不变. |
| (5)再将步骤(4)得到的氧化铁放入盛有足量稀盐酸的烧杯里,发现氧化铁消失,逐渐形成棕黄色溶液. | 实验说明分离后得到的氧化铁的________也保持不变. |
实验室常用下列装置制取有关气体.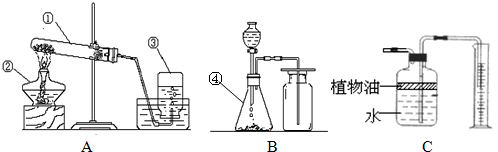
请回答下列问题:
(1)写出编号仪器的名称:①________ ②________③________④________
(2)用KMnO4固体来制取O2,应选用上图中的________装置(填A或B).该发生装置还可以做我们学过的碳酸氢铵、铜绿分解实验,用写出这两个反应的文字表达式:________、________.
(3)C装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是________,植物油上方原有的空气对实验的结果________填“有”或“没有”)明显影响.
(4)氨气(NH3)的密度比空气的小,极易溶于水,实验室制取氨气的反应原理是:
氢氧化钙(固)+氯化铵(固)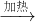 氯化钙(固)+氨气+水.
氯化钙(固)+氨气+水.
实验室制取氨气,若选择A装置,应该将此装置如何改动?________.
(5)实验室里还可采用B图装置,通过用MnO2作催化剂分解过氧化氢(H202)的方法制取氧气.写出该反应的文字表达式:________.
(6)某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究.他们进行了以下实验:
①往盛有5mL5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5mLω%H2O2溶液的试管中,加入a克MnO2,伸入带火星的木条,木条复燃.
③往盛有5mLω%H2O2溶液的试管中,加入a克Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②,③中反应后试管中仍分别含有a克MnO2和a克Fe2O3.
问题:
(1)MnO2和Fe2O3是上述反应中的________剂.
(2)实验②,③中的H2O2的浓度(ω%)以________为宜.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需的时间
浓度 时间(min) 条件 | 30%H2O2溶液 | 15%H2O2溶液 | 5%H2O2溶液 |
| a克MnO2 | 0.2 | 0.8 | 2.0 |
| a克Fe2O3 | 7.0 | 9.0 | 16.0 |