网址:http://m.1010jiajiao.com/timu3_id_92660[举报]
用如右图所示的装置制取氢气,在多孔塑料板上放锌粒,稀H2SO4由A中加入,若打开弹簧夹,酸液由A中流下与锌粒接触即发生反应,产生的氢气由支管导出,试完成下列问题:
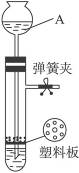
(1)仪器A的名称是_________。
(2)检查此装置的气密性时,关闭弹簧夹,从仪器A处注入适量的___________形成液封后,若看到仪器A内___________,则表明装置气密性良好。
(3)若关闭弹簧夹,容器内继续反应产生的氢气会使容器内___________,将酸液压回仪器A中,使酸液与锌粒___________,反应即自行停止。
(4)若氢气发生装置气密性良好,该同学用排水法收集一试管氢气,经检验不纯,你认为可能的原因是_____________________________________________________________________。
(5)若在塑料隔板上放小块大理石,A中放稀HCl,___________(填“能”或“否”)用弹簧夹控制CO2的发生和停止。
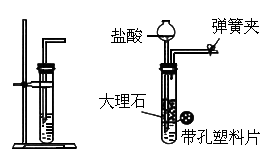
查看习题详情和答案>>如下图中左图是实验室用大理石和盐酸制备
 的简易装置,该装置在使用时存在一些缺点,针对这些不足之处,某同学设计了下图中右图改进装置.
的简易装置,该装置在使用时存在一些缺点,针对这些不足之处,某同学设计了下图中右图改进装置.
(1)
按下图装置所示,将大理石装在多孔塑料片上,打开橡皮管上的弹簧夹,通过长颈漏斗注入稀盐酸,使酸液恰好浸没大理石,此时观察到的现象是___________,几分钟后,关闭橡皮管上的弹簧夹,此时观察到的现象是_____________.(2)
与左图简单装置相比,右图装置的优点是_________;下图装置中哪些可以起到与下图装置相同的效果?答:___________(填序号).
(3)
另一位同学设计了如图所示的装置,你认为与装置A相比,该装置有何优点?装置中小试管有何作用?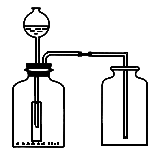
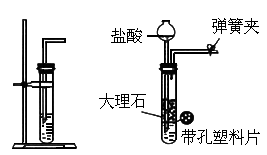
如下图中左图是实验室用大理石和盐酸制备
 的简易装置,该装置在使用时存在一些缺点,针对这些不足之处,某同学设计了下图中右图改进装置.
的简易装置,该装置在使用时存在一些缺点,针对这些不足之处,某同学设计了下图中右图改进装置.
(1)
按下图装置所示,将大理石装在多孔塑料片上,打开橡皮管上的弹簧夹,通过长颈漏斗注入稀盐酸,使酸液恰好浸没大理石,此时观察到的现象是___________,几分钟后,关闭橡皮管上的弹簧夹,此时观察到的现象是_____________.(2)
与左图简单装置相比,右图装置的优点是_________;下图装置中哪些可以起到与下图装置相同的效果?答:___________(填序号).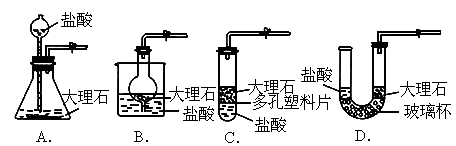
(3)
另一位同学设计了如图所示的装置,你认为与装置A相比,该装置有何优点?装置中小试管有何作用?
请根据下列装置,回答问题.

(1)写出标号①②的仪器名称:①________,②________.
(2)实验室制取H2,可选用装置________(填写装置序号)能收集到较纯净的H2.
(3)判断CO2已收集满的方法是________.
(4)由实验测知:取3.5gKMnO4晶体加热到220°C,分解放出的氧气多于按下式计算的理论量.
按下式计算的理论量为放出氧气0.354g,2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(溶于水呈紫红色) (溶于水呈绿色) (黑色,不溶)
换算成标准状况下的体积为248mL,而实际测得的氧气为308mL(标准状况),超过理论量为:(308-248)mL=60mL.试回答:
①怎样用实验证明:超理论量的氧气不是来自MnO2?
________.
②怎样用实验证明超理论量的氧气是由K2MnO4分解产生的?(要求用KMnO4制取氧气后的残渣实验,如右图所示.)________

图3检验K2MnO4分解产生氧气的实验
③通过以下四步实验操作可从“最后残渣”中分离出MnO2.正确操作的先后顺序是________(填写选项序号).
A. 烘干 B. 溶解 C. 过滤 D. 洗涤
④把③中滤液蒸发结晶可得到锰酸钾晶体,在蒸发操作中玻璃棒的作用是________.
(5)用装置F制取气体,在反应过程中,用弹簧夹夹住导气管上的橡皮管,过一会儿反应就会停止,其原因是________.
查看习题详情和答案>>
以下是中学常见的实验装置图(图1)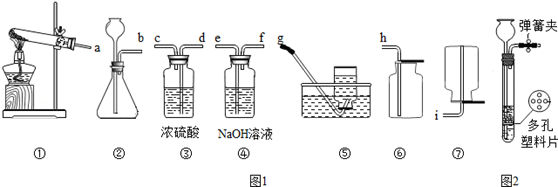
(1)实验室用锌粒和稀硫酸反应制取氢气,要制备并收集干燥的氢气,请将所选装置接口按从左到右顺序连接为 .
(2)实验室制取氧气有多种方法.
a,用KMnO4制氧气应选用 作为发生装置(填装置序号).检验该装置气密性的方法是 .
b.如用H2O2溶液制氧气,除H2O2溶液外还需要加入的试剂是 (填名称).如图2是实验室制备气体的一种装置图.该装置的特点是:打开弹簧夹,块状固体和液体接触,反应发生;关闭弹簧夹后,产生的气体将液面压回,使固体和液体分开,反应停止.用H2O2溶液制氧气时, (填“可以”或“不可以”)采用此装置.
C.实验室还用KClO3来制备氧气,该反应的化学方程式为 .将KClO3与MnO2的混合物ag加热一段时间,得到bg固体,将得到的固体溶于水,过滤、洗涤、干燥后,又得到cg固体,则KCl03的分解率为 .(用含a,b.c的式子表示)(提示:KCl03的分解率是指已分解KClO3质量与原加入KClO3质量之比.)