摘要:34.70℃时.NH4Cl的溶解度是60克.将320克此温度的饱和NH4Cl溶液蒸发掉40克水.仍然保持在70℃.求: ⑴蒸发后溶液的溶质质量分数. ⑵析出晶体的质量.
网址:http://m.1010jiajiao.com/timu3_id_90309[举报]
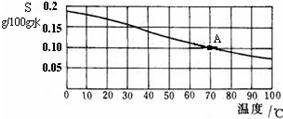 24、根据氢氧化钙的溶解度曲线,完成下列问题.
24、根据氢氧化钙的溶解度曲线,完成下列问题.(1)曲线A点表示的意义是
70℃时,氢氧化钙的溶解度是0.1克
.(2)根据曲线判断常温下(20℃)氢氧化钙的溶解性为
微溶
(填“易溶”、“可溶”、“微溶”或“难溶”).(3)曲线上满足A点的溶液在升高温度后会产生的现象是:
出现浑浊现象
.(4)若向曲线上满足A点的溶液中加入生石灰,形成石灰乳是不均一、不稳定的混合物,该混合液体液体属于
悬浊液
,此时溶液中的溶质质量变化情况
减少
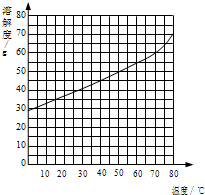 氯化铵是一种常见的化学肥料,请根据题给信息回答:
氯化铵是一种常见的化学肥料,请根据题给信息回答:(1)氯化铵(NH4Cl)的相对分子质量是
(2)右图为氯化铵溶解度曲线图,在70℃时,氯化铵的溶解度约为
(2012?济南)南海是我国的固有领海,南海蕴藏着丰富的海洋资源.
(1)我国科学家在南海海底发现了一种蕴藏量极大的新型矿产资源--天然气水合物,它是天然气(主要成分是CH4)和水形成的冰状固体,极易燃烧,又称“可燃冰”.它被认为是一种清洁能源,原因是
(2)从海水中提取单质镁的过程如下图所示:
在上述转化过程中,所发生的化学反应属于复分解反应的是
 (3)我国化学科学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3和NH4Cl产品.Na2CO3和NH4Cl的溶解度曲线如图所示.回答下列问题:
(3)我国化学科学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3和NH4Cl产品.Na2CO3和NH4Cl的溶解度曲线如图所示.回答下列问题:
①t1℃时,NH4Cl的溶解度
②t2℃时,Na2CO3饱和溶液的溶质质量分数
③t1℃时,一小试管内盛有Na2CO3的饱和溶液,试管底部还存有少许Na2CO3固体,将小试管放入盛有水的烧杯中,现将多量的NaOH固体加入烧杯内的水中,小试管内的固体物质逐渐溶解,原因是
查看习题详情和答案>>
(1)我国科学家在南海海底发现了一种蕴藏量极大的新型矿产资源--天然气水合物,它是天然气(主要成分是CH4)和水形成的冰状固体,极易燃烧,又称“可燃冰”.它被认为是一种清洁能源,原因是
燃烧产物是水和二氧化碳,不污染环境
燃烧产物是水和二氧化碳,不污染环境
.(2)从海水中提取单质镁的过程如下图所示:

在上述转化过程中,所发生的化学反应属于复分解反应的是
①②
①②
(填反应顺序标号). (3)我国化学科学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3和NH4Cl产品.Na2CO3和NH4Cl的溶解度曲线如图所示.回答下列问题:
(3)我国化学科学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3和NH4Cl产品.Na2CO3和NH4Cl的溶解度曲线如图所示.回答下列问题:①t1℃时,NH4Cl的溶解度
大于
大于
Na2CO3的溶解度(填“大于”“小于”“等于”之一).②t2℃时,Na2CO3饱和溶液的溶质质量分数
等于
等于
NH4Cl饱和溶液的溶质质量分数(填“大于”“小于”“等于”之一).③t1℃时,一小试管内盛有Na2CO3的饱和溶液,试管底部还存有少许Na2CO3固体,将小试管放入盛有水的烧杯中,现将多量的NaOH固体加入烧杯内的水中,小试管内的固体物质逐渐溶解,原因是
氢氧化钠溶于水放出热量,温度升高,碳酸钠的溶解度增大,变为不饱和溶液,所以又能溶解碳酸钠了.
氢氧化钠溶于水放出热量,温度升高,碳酸钠的溶解度增大,变为不饱和溶液,所以又能溶解碳酸钠了.
.
“联合制碱法”是我国科学家侯德榜首创的一种纯碱生产方法.其中的主要反应之一是:NH4HCO3+X→NaHCO3↓+NH4Cl,请回答:
(1)根据质量守恒定律可知反应物X的化学式是 .
(2)产物中NH4Cl是一种化学肥料,它属于 肥.
(3)70℃时,100gNH4Cl溶液的质量分数是 (该温度时,NH4Cl的溶解度为60g).
查看习题详情和答案>>
(1)根据质量守恒定律可知反应物X的化学式是
(2)产物中NH4Cl是一种化学肥料,它属于
(3)70℃时,100gNH4Cl溶液的质量分数是
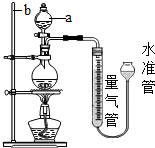 实验室常用加热(85℃)NH4Cl和NaNO2两种饱和溶液的方法制取N2,如图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题:
实验室常用加热(85℃)NH4Cl和NaNO2两种饱和溶液的方法制取N2,如图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题:【查阅资料】:
1、NH4Cl和NaNO2反应生成NaCl、H2O及N2,并放出大量热量;
2、20℃时,NH4Cl的溶解度约为37g;
3、N2难溶于水,实验条件下,密度为1.25g?L-1.
【实验步骤】:
①
②20℃时,取0.78g饱和NH4Cl溶液放入烧瓶,连接装置;
③调节水准管,使其与量气管中液面相平,记录量气管中水面读数为12mL;
④打开分液漏斗活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯;
⑤烧瓶中不再产生气泡时,关闭活塞;
⑥待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为V mL;
⑦处理剩余药品,整理实验台.
【实验分析及数据处理】:
(1)写出装置中仪器的名称:a、
(2)反应的化学方程式为:
(3)完善实验步骤中的所缺部分:①
(4)步骤④中,移走酒精灯的目的是
(5)NH4Cl是一种
(6)根据计算结果,步骤⑥中V的数值为
(7)实验中,实际测得氮气的体积偏大,可能原因是
A.实验中加入饱和NaNO2溶液的体积也被作为生成N2的体积
B.装置漏气. 查看习题详情和答案>>