摘要:33.锌和稀H2SO4总质量为30克.完全反应后质量减少至29.8克.求有多少克的锌发生了反应. 33 6.5克
网址:http://m.1010jiajiao.com/timu3_id_90308[举报]
石灰石是重要矿石之一,为了测定某矿山石灰石含碳酸钙的质量分数,工厂化验员做了以下实验:
①准确称取石灰石样品12.50 g;
②量取溶质质量分数为10%的稀盐酸100 mL,将其倒入烧杯中后称量,烧杯和稀盐酸总质量为140.20 g;
③将称取的石灰石样品全部投入盛有稀盐酸的烧杯中,待其充分反应后(石灰石所含杂质不与盐酸反应),称量烧杯和反应后混合物的总质量为148.30 g.
根据以上实验数据,计算:
(1)反应中放出二氧化碳的质量.
(2)该石灰石含碳酸钙的质量分数.
查看习题详情和答案>>
(2013?锦州)街头上有许多便宜的“黄金”饰品出售,实际上它们不是黄金,而是铜锌合金,因其具有较好的机械性能和光泽度,所以常被做成饰品.现取30g该合金样品,投入到196g某浓度的稀硫酸中,恰好完全反应后,剩余的溶液和残余固体总质量为225.6g.请计算:
(1)产生氢气的质量为
(2)剩余溶液中溶质的质量分数是多少?(结果保留到1%).
查看习题详情和答案>>
(1)产生氢气的质量为
0.4
0.4
g(2)剩余溶液中溶质的质量分数是多少?(结果保留到1%).
“黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取20.0g某种黄铜投入100g某浓度的稀硫酸中,完全反应后剩余的溶液和残余固体总质量为119.8g.请计算:
(1)产生氢气的质量为 g.
(2)这种黄铜中铜的质量分数为多少?剩余溶液中溶质的质量分数是多少?写出计算过程,结果精确到0.1%. 查看习题详情和答案>>
(1)产生氢气的质量为
(2)这种黄铜中铜的质量分数为多少?剩余溶液中溶质的质量分数是多少?写出计算过程,结果精确到0.1%. 查看习题详情和答案>>
某学生研究性学习小组对一定量木炭粉与三氧化二铁反应产物中气体成分进行研究.
I:假设:该反应的气体产物全部是二氧化碳.
II:设计方案:将一定量三氧化铁在隔绝氧气的条件下与一定量木炭粉完全反应,测定参加反应的碳元素与氧元素的质量比,计算出反应产物中碳、氧原子的数目比.
III.研阅资料:氮气不与碳、三氧化二铁发生反应,可用来隔绝氧气.实验室可以用饱和氯化铵(NH4C1)溶液和饱和亚硝酸钠
(NaNO2)溶液混合加热反应制得氮气,产物中还有氯化钠和水.
(1)写出制取氮气反应的化学方程式 ;
(2)该实验装置与实验室制取下列气体相同的是 (填标号);
A、用稀盐酸和锌反应制H2 B、用MnO2和浓盐酸加热反应制C12 C、用KC1O3与MnO2共热反应制O2
IV:实验操作步骤、现象:
(1)实验前要 ;
(2)称取3.2g三氧化二铁与2.0g木炭粉均匀混合,放入质量为48.48g的玻璃管中,按如图所示装置(必要的固定装置和加热装置均已略去)进行实验.
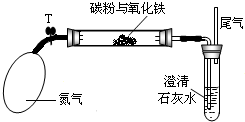
(3)加热前,选通一段时间纯净、干燥的氮气.其目的是 ;
(4)夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊.该现象说明 ;
(5)完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24g;
V:数据处理:经计算,参加反应的碳元素质量为0.48g,氧元素质量为0.96g;
VI:结论:根据数据处理结果,得出原假设不成立.理由是 .
查看习题详情和答案>>
I:假设:该反应的气体产物全部是二氧化碳.
II:设计方案:将一定量三氧化铁在隔绝氧气的条件下与一定量木炭粉完全反应,测定参加反应的碳元素与氧元素的质量比,计算出反应产物中碳、氧原子的数目比.
III.研阅资料:氮气不与碳、三氧化二铁发生反应,可用来隔绝氧气.实验室可以用饱和氯化铵(NH4C1)溶液和饱和亚硝酸钠
(NaNO2)溶液混合加热反应制得氮气,产物中还有氯化钠和水.
(1)写出制取氮气反应的化学方程式
(2)该实验装置与实验室制取下列气体相同的是
A、用稀盐酸和锌反应制H2 B、用MnO2和浓盐酸加热反应制C12 C、用KC1O3与MnO2共热反应制O2
IV:实验操作步骤、现象:
(1)实验前要
(2)称取3.2g三氧化二铁与2.0g木炭粉均匀混合,放入质量为48.48g的玻璃管中,按如图所示装置(必要的固定装置和加热装置均已略去)进行实验.

(3)加热前,选通一段时间纯净、干燥的氮气.其目的是
(4)夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊.该现象说明
(5)完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24g;
V:数据处理:经计算,参加反应的碳元素质量为0.48g,氧元素质量为0.96g;
VI:结论:根据数据处理结果,得出原假设不成立.理由是