网址:http://m.1010jiajiao.com/timu3_id_90157[举报]
(14分)将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习小组欲对蓝色固体的成分进行探究。请完成下列各题:
(一)猜想与假设:
猜想一:固体为CuCO3,理由: (用化学反应方程式表示)。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈 (填“酸”或“碱”)性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
(二)资料查阅:
①Cu(OH)2和CuCO3晶体均不带结晶水;
②Cu(OH)2、CuCO3受热易分解,化学反应方程式分别为:
Cu(OH)2==CuO+H2O CuCO3==CuO+CO2
③无水CuSO4遇水变蓝色。
(三)设计与实验:
Ⅰ.固体的获取:
将反应后的固、液混合物经过滤、洗涤、低温烘干得蓝色固体。
Ⅱ.用下图所示装置,定性探究固体的成分。
(1)若用装置A、B组合进行实验,B中无现象,则猜想 正确;
(2)若用装置A、C组合进行实验,C中无现象,则猜想 正确;
(3)小组同学将装置按 A、 、 (填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的;实验中: C中的现象 。
结论:固体为Cu(OH)2和CuCO3的混合物。
Ⅲ.固体成分定量测定:
已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量变化与分解温度的关系如下图,请根据图示回答下列问题:
(4)根据图示从A点到达B点时的固体质量差,求被分解的氢氧化铜的质量(写出计算过程)。
(5)通过计算可得32.0g固中C元素和H元素的质量比= 。
(6)若将24.0g剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式: 。
(一)猜想与假设:
猜想一:固体为CuCO3,理由: (用化学反应方程式表示)。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈 (填“酸”或“碱”)性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
(二)资料查阅:
①Cu(OH)2和CuCO3晶体均不带结晶水;
②Cu(OH)2、CuCO3受热易分解,化学反应方程式分别为:
Cu(OH)2==CuO+H2O CuCO3==CuO+CO2
③无水CuSO4遇水变蓝色。
(三)设计与实验:
Ⅰ.固体的获取:
将反应后的固、液混合物经过滤、洗涤、低温烘干得蓝色固体。
Ⅱ.用下图所示装置,定性探究固体的成分。
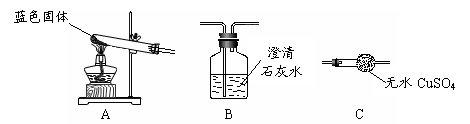
(1)若用装置A、B组合进行实验,B中无现象,则猜想 正确;
(2)若用装置A、C组合进行实验,C中无现象,则猜想 正确;
(3)小组同学将装置按 A、 、 (填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的;实验中: C中的现象 。
结论:固体为Cu(OH)2和CuCO3的混合物。
Ⅲ.固体成分定量测定:
已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量变化与分解温度的关系如下图,请根据图示回答下列问题:
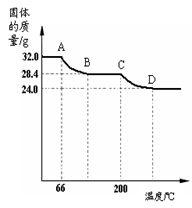
(4)根据图示从A点到达B点时的固体质量差,求被分解的氢氧化铜的质量(写出计算过程)。
(5)通过计算可得32.0g固中C元素和H元素的质量比= 。
(6)若将24.0g剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式: 。
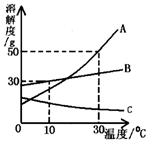
(2)将10℃的A、B两种物质的饱和溶液降温至0℃,析出固体的质量大小是A _______ B(填“>”,“<”,“=”或 “无法判断”)。
(3)将30℃A、B、C饱和溶液降温至10℃,所得溶液溶质质量分数由小到大的顺序是________。
(4)A物质的饱和溶液中含有少量B物质,通过__________方法可以提纯其中的A物质。
右图是A、B、C三种物质的溶解度曲线,根据右图
回答下列问题:
①30℃时向两个都盛有100g水的烧杯中,分别加入 A、B两种物质至不能溶解为止,溶液的溶质质量分数较大的是 溶液(填“A”或“B”)。
②将10℃的A、B两种物质的饱和溶液降温至0℃, 析出固体的质量大小是A B(填“>”, “<”,“=”或“无法判断”)。
③将30℃A、B、C饱和溶液降温至10 ℃,所得溶液溶质质量分数由小到大的顺序是 。
④A物质的饱和溶液中含有少量B物质,通过 方法可以提纯其中的A物质。
 |
查看习题详情和答案>>
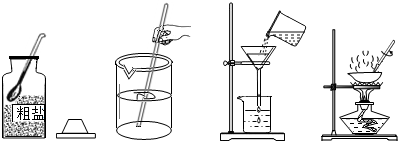
(1)规范的操作是实验成功的前提,下列实验操作正确的是
A.用天平称量氯化钠,应先调零,然后垫称量纸称取氯化钠
B.蒸发操作时,蒸发皿必须放在石棉网上,用酒精灯外焰加热
C.给试管内的液体试剂加热时,试管口应略向下倾斜
D.用排水集气法,进气导管要伸入集气瓶底
(2)从左至右的操作分别是:取药品(称量),溶解,过滤以及
(3)下列混合物能通过过滤来分离的是
A. 大理石与铁粉 B. 蔗糖与水
C. CuSO4与NaOH D. KCl与MnO2
(4)若需量取9.8mL水,应选用