摘要:1.分析:⑴所给的六种物质中.有两种碱.两种盐.一种酸及一种酸性氧化物. ⑵要知道酸.碱.盐之间能发生复分解反应.但要考虑发生反应的条件. ⑶酸性氧化物能与碱反应生成盐和水.由此应该想到酸性氧化物--CO2只能 填在图中F这个长方格中.而C格及E格可以考虑填所给定的两种碱. ⑷对BaCl2要想到在给定的六种物质中.它只能与稀 H2SO4及Na2CO3反应.应 填A格中. ⑸对Na2SO4.在给定的六种物质中.它可以和BaCl2.H2SO4.Ca(OH)2这三 种物质发生反应.因此它应填在D格内. ..⑹对稀H2SO4.它在给定的六种物质中.可以和NaOH.Ca(OH)2.BaCl2. Na2CO3这四种物质发生反应.因此应填入B格内. ⑺对Ca(OH)2.它在给定的六种物质中.能与稀H2SO4.Na2CO3这两种物质反 应.因此应填入E格内. ⑻对NaOH.它在给定的六种物质中能与稀H2SO4与CO2反应.恰好填在C格 内.如下: 解: 有关反应的化学方程式, A与B:BaCl2 + H2SO4 → BaSO4↓+2Hcl B与C: H2SO4 + 2NaOH → Na2SO4 + 2H2O A与D:BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl B与D:H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2↑ C与F:2NaOH + CO2 → Na2CO3 +H2O D与E:Na2CO3 + Ca(OH)2→ CaCO3↓+2NaOH E与F: Ca(OH)2 + CO2 → CaCO3↓+H2O B与E:H2SO4 + Ca(OH)2 → CaSO4 + 2H2O
网址:http://m.1010jiajiao.com/timu3_id_89723[举报]
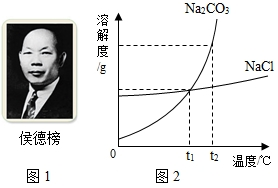
(2013?济南)1926年,我国著名化学家侯德邦先生创立了侯氏制碱法,促进了世界制碱技术的发展,以从海水中提取出来的食盐为主要原料制取纯碱.其生产过程中有下列反应:①NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl;②2NaHCO3
Na2CO3+H2O+CO2↑;
试回答下列问题:
(1)在反应①的六种物质中,焙制糕点是时常用作发酵粉的是
(2)胺盐水比食盐水更容易吸收二氧化碳的原因是
(3)氯化钠和碳酸钠的溶解度如图2,t2℃时,氯化钠饱和溶液溶质的质量分数
(填“大于”“小于”“等于”之一).
(4)生活在盐碱湖附近的人们有一句谚语“夏天晒盐,冬天捞碱”,请结合溶解度曲线,说明这句谚语的原理:
查看习题详情和答案>>
| ||
试回答下列问题:
(1)在反应①的六种物质中,焙制糕点是时常用作发酵粉的是
碳酸氢钠
碳酸氢钠
;(2)胺盐水比食盐水更容易吸收二氧化碳的原因是
氨气溶于水呈碱性,更容易吸收酸性氧化物二氧化碳
氨气溶于水呈碱性,更容易吸收酸性氧化物二氧化碳
.(3)氯化钠和碳酸钠的溶解度如图2,t2℃时,氯化钠饱和溶液溶质的质量分数
小于
小于
碳酸钠饱和溶液溶质的质量分数(填“大于”“小于”“等于”之一).
(4)生活在盐碱湖附近的人们有一句谚语“夏天晒盐,冬天捞碱”,请结合溶解度曲线,说明这句谚语的原理:
氯化钠的溶解度随湿度变化不大,由于夏天气温高,水分蒸发快,氯化钠易结晶斩出;纯碱的溶解度随温度的变化大,冬天气温很低,使碳酸钠结晶析出
氯化钠的溶解度随湿度变化不大,由于夏天气温高,水分蒸发快,氯化钠易结晶斩出;纯碱的溶解度随温度的变化大,冬天气温很低,使碳酸钠结晶析出
.
23、2009年3月以来,甲型H1N1流感疫情已在全球较大范围内传播,根据世界卫生组织报告,截至12月13日,甲型H1N1流感在全球已造成至少10582人死亡.生活中我们应注意卫生.ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒,以减缓甲型H1N1流感病毒的传播.制取ClO2的反应过程示意图如下:

请回答下列问题:
(1)在上述a、b、c、d所示的四种物质中属于氧化物的是
(2)a所示的物质中钠、氯、氧原子的个数比是
(3)制取ClO2的反应方程式为
查看习题详情和答案>>

请回答下列问题:
(1)在上述a、b、c、d所示的四种物质中属于氧化物的是
d
(填字母,下同),属于单质的是b
;(2)a所示的物质中钠、氯、氧原子的个数比是
1:1:2
,D所示的物质中氯元素和氧元素的质量比为71:64
;(3)制取ClO2的反应方程式为
2NaClO2+Cl2═2NaCl+ClO2
.(2013?海淀区一模)氯化钠是重要的调味品,是舌尖上最不可缺少的味道.下面三幅示意图分别表示不同的化学反应,但生成物中都有氯化钠.
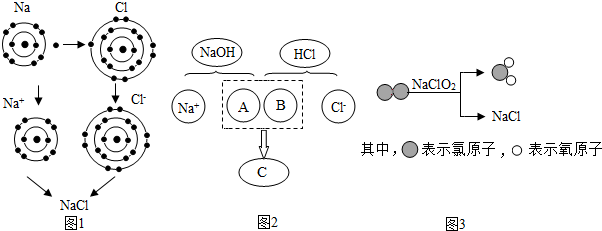
(1)图1是金属钠与氯气反应生成氯化钠的微观示意图.由图1可知,元素的化学性质与
A.最外层电子数 B.内层电子数 C.电子层数
(2)图2描述了NaOH溶液与盐酸反应的微观实质,该反应的基本反应类型为
(3)图3所示的四种物质中属于氧化物的是
查看习题详情和答案>>

(1)图1是金属钠与氯气反应生成氯化钠的微观示意图.由图1可知,元素的化学性质与
A
A
(填字母序号)有密切的关系.A.最外层电子数 B.内层电子数 C.电子层数
(2)图2描述了NaOH溶液与盐酸反应的微观实质,该反应的基本反应类型为
复分解反应
复分解反应
,图中A、B、C处应填入的化学式或离子符号依次为OH-、H+、H2O
OH-、H+、H2O
.(3)图3所示的四种物质中属于氧化物的是
ClO2
ClO2
(填化学式),该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl
Cl2+2NaClO2═2ClO2+2NaCl
.氯化钠是重要的调味品,是舌尖上最不可缺少的味道.如图三幅示意图分别表示不同的化学反应,但生成物中都有氯化钠.
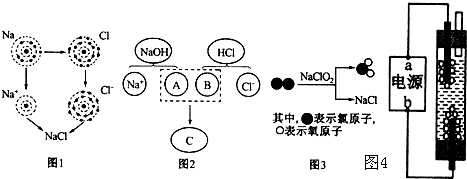
(1)图1是金属钠与氯气反应生成氯化钠的微观示意图.由图1可知,元素的化学性质主要与原子的
A.最外层电子数
B.内层电子数
C.电子层数
D.相对原子质量
(2)图2描述了NaOH溶液与盐酸反应的微观实质,该反应的基本反应类型为
A.硝酸银溶液
B.锌粒
C.碳酸钠溶液
D.石蕊
(3)图3所示的四种物质中属于氧化物的是
(4)图4是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气,从能量变化角度看,该反应中将
2NaOH+Cl2↑十H2↑,若电解含氯化钠23.4g的饱和食盐水,则可制得氢氧化钠的质量是多少?
查看习题详情和答案>>

(1)图1是金属钠与氯气反应生成氯化钠的微观示意图.由图1可知,元素的化学性质主要与原子的
最外层电子数
最外层电子数
(填字母序号)有密切的关系;A.最外层电子数
B.内层电子数
C.电子层数
D.相对原子质量
(2)图2描述了NaOH溶液与盐酸反应的微观实质,该反应的基本反应类型为
复分解
复分解
反应,图中A、B、C三种微粒的符号分别是OH-
OH-
、H+
H+
、H2O
H2O
.向反应后的液体中滴加酚酞溶液,溶液呈无色.为探究反应后溶液中是否有盐酸剩余,所选试剂不正确的是A
A
(填字母序号);A.硝酸银溶液
B.锌粒
C.碳酸钠溶液
D.石蕊
(3)图3所示的四种物质中属于氧化物的是
ClO2
ClO2
(写化学式),该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl
Cl2+2NaClO2═2ClO2+2NaCl
;(4)图4是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气,从能量变化角度看,该反应中将
电
电
能转化为化学能.该反应的化学方程式为2NaCl+2H2O
| ||