摘要:3.解:设混合气体中一氧化碳的质量为x.二氧化碳的质量为y.反应生成的二氧化碳的质量为z . CO + CuO Cu + CO2 28 80 44 x 0.8克 z x ... z Ca(OH)2 + CO2 → CaCO3↓ + H2O 44 100 (y+z) 2.0克 答:略
网址:http://m.1010jiajiao.com/timu3_id_89717[举报]
二氧化碳在食品、卫生、工业、餐饮、人工降雨、焊接等领域有着较广泛的用途.但由于化石燃料的大量燃烧等原因,空气中的二氧化碳浓度持续走高,温室效应加剧,对人类的生存环境造成了不良的影响.科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2.为此,他们设想了一系列“捕捉和处理”CO2的方法.
方法I:一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如图1所示:
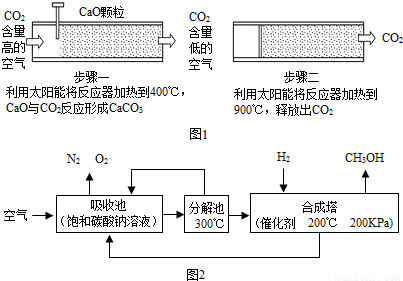
(1)步骤一中发生反应的化学方程式是 .
(2)步骤二产生的CO2较为纯净,可以把它压缩、液化后封存在泥岩中的方法,这种方法说明了CO2气体分子间 ;也可以采取“组合转化”的技术生产有用的物质,如将CO2和H2以一定比例混合,在一定条件下反应生成一种重要的化工原料.请在横线上填写该化工原料的化学式:2CO2+6H2→1 +4H2O
方法Ⅱ:[资料卡片]碳酸氢钠分解温度是270℃,碳酸钠在856℃熔化,但还未达到分解温度.
(3)吸收池中发生反应的化学方程式为 .
(4)分解池中发生反应的化学方程式为 .
(5)合成塔中发生反应的化学方程式为 .
(6)该流程中能循环利用的物质有H2O、CO2和 . 查看习题详情和答案>>
方法I:一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如图1所示:

(1)步骤一中发生反应的化学方程式是 .
(2)步骤二产生的CO2较为纯净,可以把它压缩、液化后封存在泥岩中的方法,这种方法说明了CO2气体分子间 ;也可以采取“组合转化”的技术生产有用的物质,如将CO2和H2以一定比例混合,在一定条件下反应生成一种重要的化工原料.请在横线上填写该化工原料的化学式:2CO2+6H2→1 +4H2O
方法Ⅱ:[资料卡片]碳酸氢钠分解温度是270℃,碳酸钠在856℃熔化,但还未达到分解温度.
(3)吸收池中发生反应的化学方程式为 .
(4)分解池中发生反应的化学方程式为 .
(5)合成塔中发生反应的化学方程式为 .
(6)该流程中能循环利用的物质有H2O、CO2和 . 查看习题详情和答案>>
二氧化碳在食品、卫生、工业、餐饮、人工降雨、焊接等领域有着较广泛的用途。但由于化石燃料的大量燃烧等原因,空气中的二氧化碳浓度持续走高,温室效应加剧,对人类的生存环境造成了不良的影响。科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2。为此,他们设想了一系列“捕捉和处理”CO2的方法。
方法I:一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如下图所示:
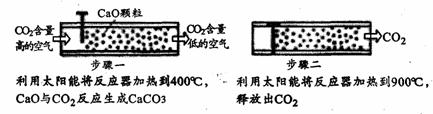
(1)步骤一中发生反应的化学方程式是 ▲ 。
(2)步骤二产生的CO2较为纯净,可以把它压缩、液化后封存在泥岩中的方法,这种方法说明了CO2气体分子间 ▲ ;也可以采取“组合转化”的技术生产有用的物质,如将CO2和H 2以一定比例混合,在一定条件下反应生成一种重要的化工原料。请在横线上填写该化工原料的化学式:2CO2+6H2→1 ▲ +4H2O
2以一定比例混合,在一定条件下反应生成一种重要的化工原料。请在横线上填写该化工原料的化学式:2CO2+6H2→1 ▲ +4H2O
方法Ⅱ:把空气吹入饱和碳酸钠溶液中,溶液可吸收CO2生成碳酸氢钠;加热碳酸氢钠固体又分解放出CO2;在合成塔内CO2与氢气反应生成甲醇(CH3OH)和水。简要的生产流程如下图所示:
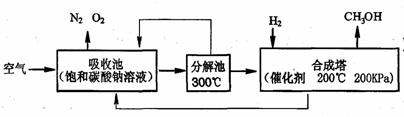
[资料卡片] 碳酸氢钠分解温度是270CC,碳酸钠在856C熔化,但还未达到分解温度。
(3)吸收池中发生反应的化学方程式为 ▲ 。
(4)分解池中发生反应的化学方程式为 ▲ 。
(5)合成塔中发生反应的化学方程式为 ▲ 。
(6)该流程中能循环利用的物质有H2O、CO2和 ▲ 。
查看习题详情和答案>>23、探究是一种重要的学习方式,是充分理解学科本质的基本途径.请你和化学兴趣小组的同学一起完成下面三个探究实验.
实验一:实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸气和CO2反应而变质.兴趣小组的同学对一瓶久置的“碱石灰”作了如下探究:
(1) 猜想
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3.
(2) 实验
如图所示:

(3) 判断
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ
b.操作④发生化学反应的方程式为
c.综合a和b的结论,判断该样品变质情况为
(4) 拓展
由上述实验说明,实验室中“碱石灰”应
实验二:向NaOH溶液中滴入紫色石蕊试液,溶液显蓝色.
(1)提出问题:是什么粒子使紫色石蕊试液变蓝色呢?
(2)查找资料:NaOH溶液中存在的粒子有大量的H2O、Na+、OH-和极少量的H+.
(3)猜想:是大量的OH-使紫色石蕊试液变蓝色.
(4)实验探究步骤及其说明:
①在一支干净试管中加入2mL蒸馏水,再滴入几滴紫色石蕊试液,溶液几乎不变色,说明
②在一支干净试管中加入2mL氯化钠溶液,再滴入几滴紫色石蕊试液,溶液几乎不变色,说明
③在一支干净试管中加入2mL
(5)结论:原假设
实验三:实验室的废液中,可能含有氯化铁、硫酸、氯化钠、碳酸钠和硝酸钡中的一种或多种.化学兴趣小组的同学对废液进行了如下试验:
(1)取废液观察,为无色溶液;
(2)取废液,向其中滴加氯化钡溶液,有白色沉淀产生,继续加入稀硝酸,无明显现象;
(3)另取废液,向其中加入铁粉后,产生大量气泡.
根据以上试验现象可推断,废液中肯定含有
通过实验还不能确定是否含有的物质是

查看习题详情和答案>>
实验一:实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸气和CO2反应而变质.兴趣小组的同学对一瓶久置的“碱石灰”作了如下探究:
(1) 猜想
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3.
(2) 实验
如图所示:

(3) 判断
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ
不成立
(填:成立、不成立).b.操作④发生化学反应的方程式为
CaCO3+2HCl═CaCl2+CO2↑+H2O
;由操作⑤⑥的现象判断:滤液中含有Na2CO3
(写化学式);由此判断猜想Ⅰ不成立
(填:成立、不成立).c.综合a和b的结论,判断该样品变质情况为
部分变质
.(4) 拓展
由上述实验说明,实验室中“碱石灰”应
密封
保存.实验二:向NaOH溶液中滴入紫色石蕊试液,溶液显蓝色.
(1)提出问题:是什么粒子使紫色石蕊试液变蓝色呢?
(2)查找资料:NaOH溶液中存在的粒子有大量的H2O、Na+、OH-和极少量的H+.
(3)猜想:是大量的OH-使紫色石蕊试液变蓝色.
(4)实验探究步骤及其说明:
①在一支干净试管中加入2mL蒸馏水,再滴入几滴紫色石蕊试液,溶液几乎不变色,说明
H2O不能使石蕊试液变蓝色
;②在一支干净试管中加入2mL氯化钠溶液,再滴入几滴紫色石蕊试液,溶液几乎不变色,说明
Na+不能使紫色石蕊试液变蓝色
;③在一支干净试管中加入2mL
氢氧化钠
溶液,再滴入几滴紫色石蕊试液,溶液变蓝色,说明OH-能使紫色石蕊试液变蓝色.(5)结论:原假设
成立
.(填“成立”或“不成立”)实验三:实验室的废液中,可能含有氯化铁、硫酸、氯化钠、碳酸钠和硝酸钡中的一种或多种.化学兴趣小组的同学对废液进行了如下试验:
(1)取废液观察,为无色溶液;
(2)取废液,向其中滴加氯化钡溶液,有白色沉淀产生,继续加入稀硝酸,无明显现象;
(3)另取废液,向其中加入铁粉后,产生大量气泡.
根据以上试验现象可推断,废液中肯定含有
硫酸
,肯定不含有氯化铁、碳酸钠、硝酸钡
.通过实验还不能确定是否含有的物质是
氯化钠
.为了确定它是否存在,同学们设计了下面的实验方案,请按同学们的思路填写表:
(2013?昆山市二模)二氧化碳在食品、卫生、工业、餐饮、人工降雨、焊接等领域有着较广泛的用途.但由于化石燃料的大量燃烧等原因,空气中的二氧化碳浓度持续走高,温室效应加剧,对人类的生存环境造成了不良的影响.科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2.为此,他们设想了一系列“捕捉和处理”CO2的方法.
方法I:一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如图1所示:

(1)步骤一中发生反应的化学方程式是
(2)步骤二产生的CO2较为纯净,可以把它压缩、液化后封存在泥岩中的方法,这种方法说明了CO2气体分子间
方法Ⅱ:[资料卡片]碳酸氢钠分解温度是270℃,碳酸钠在856℃熔化,但还未达到分解温度.
(3)吸收池中发生反应的化学方程式为
(4)分解池中发生反应的化学方程式为
(5)合成塔中发生反应的化学方程式为
(6)该流程中能循环利用的物质有H2O、CO2和
查看习题详情和答案>>
方法I:一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如图1所示:

(1)步骤一中发生反应的化学方程式是
CaO+CO2
CaCO3(条件写加热也可)
| ||
CaO+CO2
CaCO3(条件写加热也可)
.
| ||
(2)步骤二产生的CO2较为纯净,可以把它压缩、液化后封存在泥岩中的方法,这种方法说明了CO2气体分子间
有较大空隙
有较大空隙
;也可以采取“组合转化”的技术生产有用的物质,如将CO2和H2以一定比例混合,在一定条件下反应生成一种重要的化工原料.请在横线上填写该化工原料的化学式:2CO2+6H2→1C2H4
C2H4
+4H2O方法Ⅱ:[资料卡片]碳酸氢钠分解温度是270℃,碳酸钠在856℃熔化,但还未达到分解温度.
(3)吸收池中发生反应的化学方程式为
Na2CO3+H2O+CO2═2NaHCO3
Na2CO3+H2O+CO2═2NaHCO3
.(4)分解池中发生反应的化学方程式为
2NaHCO3
Na2CO3+H2O+CO2↑(条件写加热也可)
| ||
2NaHCO3
Na2CO3+H2O+CO2↑(条件写加热也可)
.
| ||
(5)合成塔中发生反应的化学方程式为
CO2+3H2
CH3OH+H2O(条件写催化剂、加热、加压也可)
| ||
| 200℃、200KPa |
CO2+3H2
CH3OH+H2O(条件写催化剂、加热、加压也可)
.
| ||
| 200℃、200KPa |
(6)该流程中能循环利用的物质有H2O、CO2和
Na2CO3
Na2CO3
.碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂.某研究性
学习小组对在空气中长期露置已变质的碱石灰样品进行如下探究.
Ⅰ.定性探究
[提出问题]碱石灰样品中可能含有哪些物质?
[猜 想]猜想一:可能含有Na2C03,作出此猜想的依据是
猜想二:可能含有Ca(OH)2,作出此猜想的依据是
[设计实验]
[提示]Na2C03和 Ca(OH)2溶于水均无明显热量变化.
[交流与讨论]
(1)小鹏同学提出:“步骤①中形成浊液,说明样品中含有碳酸钙”,你认为他的观点
(2)小虎同学认为本实验设计中,碱石灰样品中是否有CaC03是无法证明的.于是他和小兰,小娟认真探究,设计出了判断是否有CaC03的实验方案:他(她)们取几大块已变质的碱石灰样品,从表面刮取一定量的固体,进行
Ⅱ.定量探究
[提出问题]样品中碳酸钠的质量分数的最大值是多少呢?小娟同学设计了以下方案:

则样品中Na2C03的质量分数的最大值是多少?(写出计算过程)
[交流与反思]
小兰同学认为小娟同学得到的计算结果不准确.因为稀盐酸有挥发性,可能导致测得的碳酸钠的质量分数偏大.由于挥发量不大,可以忽略不计.
查看习题详情和答案>>
学习小组对在空气中长期露置已变质的碱石灰样品进行如下探究.
Ⅰ.定性探究
[提出问题]碱石灰样品中可能含有哪些物质?
[猜 想]猜想一:可能含有Na2C03,作出此猜想的依据是
CO2+2NaOH=Na2CO3+H2O
CO2+2NaOH=Na2CO3+H2O
(用化学方程式表示).猜想二:可能含有Ca(OH)2,作出此猜想的依据是
氧化钙吸收水生成氢氧化钙
氧化钙吸收水生成氢氧化钙
(用简洁的文字表述).[设计实验]
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量样品置于试管中,加足量的水溶解,观察并用手触摸试管外壁 | 形成浊液 试管外壁发热 |
则样品中CaO 和 Ca(OH)2、CaCO3 Ca(OH)2、CaCO3 至少有一种 |
| ②将①的浊液过滤,向所得的滤液中逐滴加入氯化钙溶液至过量 | 产生白色沉淀 |
样品中含有的物质是 Na2CO3 Na2CO3 |
| ③将②的浊液过滤,向所得的滤液中滴加几滴酚酞溶液 | 溶液 变成红色 变成红色 |
由步骤①可知:最后滤液一定显碱性, 因此无法检验样品中的Ca(OH)2 |
[交流与讨论]
(1)小鹏同学提出:“步骤①中形成浊液,说明样品中含有碳酸钙”,你认为他的观点
不正确
不正确
(填“正确”或“不正确”).(2)小虎同学认为本实验设计中,碱石灰样品中是否有CaC03是无法证明的.于是他和小兰,小娟认真探究,设计出了判断是否有CaC03的实验方案:他(她)们取几大块已变质的碱石灰样品,从表面刮取一定量的固体,进行
高温煅烧
高温煅烧
(操作方法),再将产生的气体通入澄清的石灰水,变浑浊,证明样品中有碳酸钙(提示:碳酸钠高温不分解).Ⅱ.定量探究
[提出问题]样品中碳酸钠的质量分数的最大值是多少呢?小娟同学设计了以下方案:

则样品中Na2C03的质量分数的最大值是多少?(写出计算过程)
[交流与反思]
小兰同学认为小娟同学得到的计算结果不准确.因为稀盐酸有挥发性,可能导致测得的碳酸钠的质量分数偏大.由于挥发量不大,可以忽略不计.