摘要:固体物质的溶解度是在一定 下.某物质在 克溶剂里达到 状态时.所溶解的溶质的质量.溶解度的单位是 .
网址:http://m.1010jiajiao.com/timu3_id_89624[举报]
固体物质的溶解性与溶质性质、溶剂性质和温度三个因素有关,某实验小组要探究不同溶剂对物质溶解性的影响,请你一起参与.
提出假设:
实验设计:
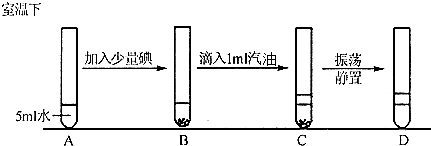
分析现象:
结论应用:请你举出与这个因素有关的一个应用实例:
问题讨论:D的上层溶液
查看习题详情和答案>>
提出假设:
在相同温度下,同一溶质在不同溶剂中的溶解性不同
在相同温度下,同一溶质在不同溶剂中的溶解性不同
.实验设计:

分析现象:
| 实验现象 | 实验结论 |
| B中碘部分溶于水,水溶液呈棕黄色. C中水浴汽油分层,汽油浮在水面上. D中下层溶液颜色变为无色,无固体残渣,上层由无色变为紫红色. |
衣服上的油渍用水很难洗去,用汽油却很容易洗去
衣服上的油渍用水很难洗去,用汽油却很容易洗去
问题讨论:D的上层溶液
不一定是
不一定是
饱和溶液(填“是”、“不是”、“不一定是”),请你设计实验方案验证你的结论.取上层碘的汽油溶液于试管中,再加少量碘固体,振荡静置.
若固体溶解,则原溶液为不饱和溶液,若固体不溶解,则原溶液为饱和溶液
若固体溶解,则原溶液为不饱和溶液,若固体不溶解,则原溶液为饱和溶液
取上层碘的汽油溶液于试管中,再加少量碘固体,振荡静置.
若固体溶解,则原溶液为不饱和溶液,若固体不溶解,则原溶液为饱和溶液
.若固体溶解,则原溶液为不饱和溶液,若固体不溶解,则原溶液为饱和溶液
4、固体溶解度是指在一定温度下,某固体在
查看习题详情和答案>>
100g
溶剂里达到饱和
状态时所溶解的质量
.影响固体物质在水中溶解度大小的外在因素是:温度
,大部分物质如硝酸钾的溶解度随温度的升高而增大
,少数物质如食盐的溶解度随温度变化不大
,只有极少数物质如氢氧化钙
溶解度随温度升高而减小
.下图为甲、乙两种固体物质的溶解度曲线。

⑴溶解度随温度升高而增大的物质是 (填“甲”或“乙”);
⑵某同学在t1℃时进行如图2实验,充分搅拌得到相应的液体①一③。①一③形成的溶液中属于饱和溶液的是 (填序号);
⑶在溶液③中再加入25g甲,充分搅拌,所得溶液中溶质的质量分数为 (精确到0.1%)。
⑷若固体甲中含少量固体乙,在提纯固体甲时一定要用到的玻璃仪器有 ;
⑸若甲为KNO3,如图3所示,20℃时,将盛有饱和KNO3溶液
的小试管放入盛水的烧杯中,向烧杯中加入某物质后,试管中
有晶体析出。加入的物质可能是下列中的 (填字母序号)。

A氢氧化钠固体 B生石灰固体 C冰块
D硝酸铵固体 E.浓硫酸

⑴溶解度随温度升高而增大的物质是 (填“甲”或“乙”);
⑵某同学在t1℃时进行如图2实验,充分搅拌得到相应的液体①一③。①一③形成的溶液中属于饱和溶液的是 (填序号);
⑶在溶液③中再加入25g甲,充分搅拌,所得溶液中溶质的质量分数为 (精确到0.1%)。
⑷若固体甲中含少量固体乙,在提纯固体甲时一定要用到的玻璃仪器有 ;
⑸若甲为KNO3,如图3所示,20℃时,将盛有饱和KNO3溶液
的小试管放入盛水的烧杯中,向烧杯中加入某物质后,试管中
有晶体析出。加入的物质可能是下列中的 (填字母序号)。

A氢氧化钠固体 B生石灰固体 C冰块
D硝酸铵固体 E.浓硫酸
 CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程.请你参与探究过程:
CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程.请你参与探究过程:(1)在操作一实验过程中,同学们发现向样品中加水时还放出大量的热.据此实验,下列对样品成分分析正确的是
D
D
(填序号).A.一定有NaOH B.一定有Na2CO3
C.一定有CaO D.至少有NaOH、CaO中的一种
(2)为了使样品充分溶解,操作一定还要用到的玻璃仪器是
玻璃棒
玻璃棒
;操作二的名称是过滤
过滤
.(3)固体A中一定含有
碳酸钙(CaCO3)
碳酸钙(CaCO3)
.(4)溶液B成分的探究.
【查阅资料】①Ca(OH)2、Na2CO3溶于水无明显的温度变化;②Na2CO3溶液呈碱性,能使酚酞试液变红;③CaCl2溶液呈中性.
【猜想】溶液B中溶质可能为:①NaOH②Na2CO3 ③NaOH和Na2CO3④Ca(OH)2和
NaOH
NaOH
.【设计方案并进行实验】甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3.
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质可能含有NaOH.为进一步确认溶液B中溶质的成分,做了如下实验.
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量溶液B于试管中,加入足量CaCl2溶液; ②过滤,在滤液中滴加酚酞试液 |
① 有白色沉淀生成 有白色沉淀生成 ② 溶液由无色变为红色 溶液由无色变为红色 |
猜想③正确 |
CaCl2+Na2CO3=2NaCl+CaCO3↓
CaCl2+Na2CO3=2NaCl+CaCO3↓
,其实验目的是除尽溶液B中的Na2CO3,避免干扰NaOH的检验
除尽溶液B中的Na2CO3,避免干扰NaOH的检验
.CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程. 请你参与探究过程:
(1)为了使样品充分溶解,操作一定还要用到的玻璃仪器是 ;操作二的名称是 .
(2)固体A中一定含有 .
(3)溶液B成分的探究.
[查阅资料]
①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②Na2CO3溶液呈碱性,能使酚酞试液变红;
③CaCl2溶液呈中性.
[猜想]
溶液B中溶质可能为:①NaOH; ②Na2CO3; ③NaOH和Na2CO3;④Ca(OH)2和
[设计方案并进行实验]
甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3.
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质一定含有NaOH.
[反思与评价]
丙同学认真分析上述二位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.他认为B溶液中一定含有Na2CO3,可能含有NaOH.为进一步确认溶液B中是否含NaOH,做做了如下实验.
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量溶液B于试管中,加入足量CaCl2溶液; ②过滤,在滤液中滴加酚酞试液 | ①有白色沉淀生成 ②溶液由无色变为红色 | 猜想③正确 |
实验步骤①中发生的化学反应方程式是 ,其实验目的是 .
(4)实验过程中,同学们发现向样品中加水时还放出大量的热.综合以上探究,下列对样品成分分析正确的是 (填序号).
A.一定有NaOH B.一定有Na2CO3 C.一定有CaO D.至少有NaOH、CaO中的一种. 查看习题详情和答案>>