摘要:1.金属能与氧气.酸以及某些盐溶液发生化学反应.
网址:http://m.1010jiajiao.com/timu3_id_89156[举报]
某学生查得以下资料:在稀H2SO4溶液中,H2SO4产生了能够自由移动的H+和SO42-,这样的过程称为电离,HCl、NaOH、KNO3在水溶液中均发生电离.锌与稀H2SO4、稀HCl反应的实质是:稀H2SO4、稀HCl电离出H+,H+与Al发生置换反应而生成H2.研究表明,在其他条件相同时,同样的铝片与浓度相等的稀硫酸、稀盐酸反应生成H2的反应剧烈程度相等.浓度增大,则反应更剧烈.该学生在一次实验中用铝片分别跟H+浓度相等的稀盐酸、稀硫酸反应,结果发现铝片跟稀盐酸反应现象非常明显,而跟稀硫酸却几乎不反应.这一结果和上述资料的记载不一致,是什么原因呢?为了寻找原因,该学生在教师指导下重新用纯度极高的浓硫酸和浓盐酸配制了一定浓度的稀溶液,然后加入规格(0.1×10×25mm)相同、纯度≥99.5%的铝片,验证是否确实存在上述现象,实验结果如下表:
注:a% HCl 与b% H2SO4中H+浓度相同,c% H2SO4中H+浓度大于a% HCl中H+浓度.
(1)为了探究“铝跟稀盐酸、稀硫酸反应存在差异的原因”,你能对该原因作出哪些假设(或猜想)?
假设一:
假设二:
(2)请你设计一个实验方案来验证你的假设,写出你的设计思路(或设计原理).
查看习题详情和答案>>
| 酸及反应进程 | 1min | 2min | 5min | 15min | 20min |
| a% HCl | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| b% H2SO4 | 均无明显现象(无气泡) | ||||
| c% H2SO4 | 均无明显现象(无气泡) | ||||
(1)为了探究“铝跟稀盐酸、稀硫酸反应存在差异的原因”,你能对该原因作出哪些假设(或猜想)?
假设一:
Cl-促进金属铝表面的氧化膜与H+反应
Cl-促进金属铝表面的氧化膜与H+反应
;假设二:
SO42-对金属铝表面的氧化膜与H+反应对起阻碍作用
SO42-对金属铝表面的氧化膜与H+反应对起阻碍作用
.(2)请你设计一个实验方案来验证你的假设,写出你的设计思路(或设计原理).
①向3支试管中分别加入5mL5%H2SO4溶液和已给铝片,向其中一支加入少量的Na2SO4晶体,无明显想象(同未加的对比);向另一支试管中加入少量的NaCl晶体,有气泡产生(同未加的对比);②向2支试管中分别加入5mL10%HCl溶液和已给铝片,向其中一支试管中加入少量的Na2SO4晶体,气泡立即明显减少(和另一支未加相比).
①向3支试管中分别加入5mL5%H2SO4溶液和已给铝片,向其中一支加入少量的Na2SO4晶体,无明显想象(同未加的对比);向另一支试管中加入少量的NaCl晶体,有气泡产生(同未加的对比);②向2支试管中分别加入5mL10%HCl溶液和已给铝片,向其中一支试管中加入少量的Na2SO4晶体,气泡立即明显减少(和另一支未加相比).
.气体的制备:这学期我们已经学会在实验室制取氧气、二氧化碳等气体,熟悉了实验装置的选择、气体的收集,同时能够发现一些规律.
(1)根据装置图回答下列问题(装置用代号表示):

写出有编号的仪器名称:①
(2)某实验小组根据所学的气体制备知识来探究SO2气体.下表是三种气体的密度(在0℃、101kPa条件下测定)和溶解度(在20℃、101kPa条件下测定).
①若收集SO2气体,选用图1中的
②有同学提出SO2气体会污染空气,于是采用图2装置收集SO2,则气体应该从
③上述②中排出的尾气还需要用氢氧化钠溶液吸收,以防止污染环境.如果用右图装置盛氢氧化钠溶液吸收尾气,则尾气应该从
(3)该实验小组查阅资料发现:大家公认对氢气的发现和研究有过很大贡献的是英国化学家卡文迪许,他于1766年发现用铁和锌等金属作用于盐酸及稀硫酸可制得氢气.同学们提出了如下问题:生成氢气的速率与哪些因素有关呢?请你帮助解决这一问题,填写下表:
查看习题详情和答案>>
(1)根据装置图回答下列问题(装置用代号表示):

写出有编号的仪器名称:①
长颈漏斗
长颈漏斗
;②集气瓶
集气瓶
;③酒精灯
酒精灯
.实验室用高锰酸钾制取氧气的发生装置可选用A
A
;实验室制取二氧化碳的发生装置可选用B
B
.(2)某实验小组根据所学的气体制备知识来探究SO2气体.下表是三种气体的密度(在0℃、101kPa条件下测定)和溶解度(在20℃、101kPa条件下测定).
| H2 | CO2 | SO2 | |
| 密度(g/L) | 0.08987 | 1.975 | 2.716 |
| 溶解度(g) | 0.0001603 | 0.1688 | 11.28 |
D
D
装置;②有同学提出SO2气体会污染空气,于是采用图2装置收集SO2,则气体应该从
c
c
(填写导管口代号,下同)导入该装置;③上述②中排出的尾气还需要用氢氧化钠溶液吸收,以防止污染环境.如果用右图装置盛氢氧化钠溶液吸收尾气,则尾气应该从
c
c
导入该装置.(3)该实验小组查阅资料发现:大家公认对氢气的发现和研究有过很大贡献的是英国化学家卡文迪许,他于1766年发现用铁和锌等金属作用于盐酸及稀硫酸可制得氢气.同学们提出了如下问题:生成氢气的速率与哪些因素有关呢?请你帮助解决这一问题,填写下表:
| 猜 想 | 验 证 方 法 |
| 猜想1: 与金属的活动性强弱有关 与金属的活动性强弱有关 |
将形状和大小都相同的锌片和铁片,分别放入溶质质量分数和温度都相同的稀硫酸中 将形状和大小都相同的锌片和铁片,分别放入溶质质量分数和温度都相同的稀硫酸中 |
| 猜想2: 与酸的溶质质量分数有关 与酸的溶质质量分数有关 |
将形状和大小都相同的两个锌片,分别放入温度相同但溶质质量分数不同的两种稀硫酸中 将形状和大小都相同的两个锌片,分别放入温度相同但溶质质量分数不同的两种稀硫酸中 |
气体的制备:这学期我们已经学会在实验室制取氧气、二氧化碳等气体,熟悉了实验装置的选择、气体的收集,同时能够发现一些规律.
(1)根据装置图回答下列问题(装置用代号表示):
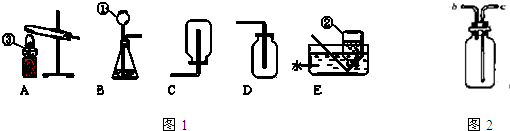
写出有编号的仪器名称:①______;②______;③______.实验室用高锰酸钾制取氧气的发生装置可选用______;实验室制取二氧化碳的发生装置可选用______.
(2)某实验小组根据所学的气体制备知识来探究SO2气体.下表是三种气体的密度(在0℃、101kPa条件下测定)和溶解度(在20℃、101kPa条件下测定).
①若收集SO2气体,选用图1中的______装置;
②有同学提出SO2气体会污染空气,于是采用图2装置收集SO2,则气体应该从______(填写导管口代号,下同)导入该装置;
③上述②中排出的尾气还需要用氢氧化钠溶液吸收,以防止污染环境.如果用右图装置盛氢氧化钠溶液吸收尾气,则尾气应该从______导入该装置.
(3)该实验小组查阅资料发现:大家公认对氢气的发现和研究有过很大贡献的是英国化学家卡文迪许,他于1766年发现用铁和锌等金属作用于盐酸及稀硫酸可制得氢气.同学们提出了如下问题:生成氢气的速率与哪些因素有关呢?请你帮助解决这一问题,填写下表:
查看习题详情和答案>>
(1)根据装置图回答下列问题(装置用代号表示):
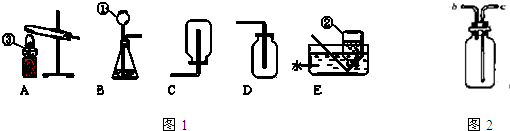
写出有编号的仪器名称:①______;②______;③______.实验室用高锰酸钾制取氧气的发生装置可选用______;实验室制取二氧化碳的发生装置可选用______.
(2)某实验小组根据所学的气体制备知识来探究SO2气体.下表是三种气体的密度(在0℃、101kPa条件下测定)和溶解度(在20℃、101kPa条件下测定).
| H2 | CO2 | SO2 | |
| 密度(g/L) | 0.08987 | 1.975 | 2.716 |
| 溶解度(g) | 0.0001603 | 0.1688 | 11.28 |
②有同学提出SO2气体会污染空气,于是采用图2装置收集SO2,则气体应该从______(填写导管口代号,下同)导入该装置;
③上述②中排出的尾气还需要用氢氧化钠溶液吸收,以防止污染环境.如果用右图装置盛氢氧化钠溶液吸收尾气,则尾气应该从______导入该装置.
(3)该实验小组查阅资料发现:大家公认对氢气的发现和研究有过很大贡献的是英国化学家卡文迪许,他于1766年发现用铁和锌等金属作用于盐酸及稀硫酸可制得氢气.同学们提出了如下问题:生成氢气的速率与哪些因素有关呢?请你帮助解决这一问题,填写下表:
| 猜 想 | 验 证 方 法 |
| 猜想1:______ | ______ |
| 猜想2:______ | ______ |
气体的制备:这学期我们已经学会在实验室制取氧气、二氧化碳等气体,熟悉了实验装置的选择、气体的收集,同时能够发现一些规律.
(1)根据装置图回答下列问题(装置用代号表示):

写出有编号的仪器名称:①______;②______;③______.实验室用高锰酸钾制取氧气的发生装置可选用______;实验室制取二氧化碳的发生装置可选用______.
(2)某实验小组根据所学的气体制备知识来探究SO2气体.下表是三种气体的密度(在0℃、101kPa条件下测定)和溶解度(在20℃、101kPa条件下测定).
①若收集SO2气体,选用图1中的______装置;
②有同学提出SO2气体会污染空气,于是采用图2装置收集SO2,则气体应该从______(填写导管口代号,下同)导入该装置;
③上述②中排出的尾气还需要用氢氧化钠溶液吸收,以防止污染环境.如果用右图装置盛氢氧化钠溶液吸收尾气,则尾气应该从______导入该装置.
(3)该实验小组查阅资料发现:大家公认对氢气的发现和研究有过很大贡献的是英国化学家卡文迪许,他于1766年发现用铁和锌等金属作用于盐酸及稀硫酸可制得氢气.同学们提出了如下问题:生成氢气的速率与哪些因素有关呢?请你帮助解决这一问题,填写下表:
查看习题详情和答案>>
(1)根据装置图回答下列问题(装置用代号表示):

写出有编号的仪器名称:①______;②______;③______.实验室用高锰酸钾制取氧气的发生装置可选用______;实验室制取二氧化碳的发生装置可选用______.
(2)某实验小组根据所学的气体制备知识来探究SO2气体.下表是三种气体的密度(在0℃、101kPa条件下测定)和溶解度(在20℃、101kPa条件下测定).
| H2 | CO2 | SO2 | |
| 密度(g/L) | 0.08987 | 1.975 | 2.716 |
| 溶解度(g) | 0.0001603 | 0.1688 | 11.28 |
②有同学提出SO2气体会污染空气,于是采用图2装置收集SO2,则气体应该从______(填写导管口代号,下同)导入该装置;
③上述②中排出的尾气还需要用氢氧化钠溶液吸收,以防止污染环境.如果用右图装置盛氢氧化钠溶液吸收尾气,则尾气应该从______导入该装置.
(3)该实验小组查阅资料发现:大家公认对氢气的发现和研究有过很大贡献的是英国化学家卡文迪许,他于1766年发现用铁和锌等金属作用于盐酸及稀硫酸可制得氢气.同学们提出了如下问题:生成氢气的速率与哪些因素有关呢?请你帮助解决这一问题,填写下表:
| 猜 想 | 验 证 方 法 |
| 猜想1:______ | ______ |
| 猜想2:______ | ______ |
查看习题详情和答案>>
冬日里的一天,某班教室的暖气片和暖气管的接口处突然爆裂,里面喷出大量的黄色液体,并伴有一些红褐色的固体.水暖师傅、老师及同学们进行了紧急抢修.事后,同学们出于好奇收集了红褐色固体进行探究.
初步分析:红褐色固体的主要成分是铁锈,铁锈的成分复杂,主要成分是 .由此联想到铁在空气中锈蚀,实际上是铁跟 、 等物质相互作用,发生一系列复杂的化学反应,使铁转化为铁的化合物.
搜集资料:
①不溶性碱
金属氧化物+水(反应前后元素化合价不变);
②暖气片是由生铁铸成的;
③当地暖气用水为硬度较大的自来水;
④铁与铜都属于金属,有部分相似的化学性质.如:铜在潮湿的空气中可以形成铜绿[化学式为Cu2(OH)2CO3].
提出猜想:请根据上述任意一条资料分析,红褐色物质中还可能含有的物质是 .(写一种物质即可),你猜想的依据是
.
设计实验:请设计一个实验来验证你的猜想(红褐色固体已干燥并研成粉末).
答:
拓展分析:通过以上探究过程,再结合资料④,你对铁生锈的条件有什么新的认识?
答: .
查看习题详情和答案>>
初步分析:红褐色固体的主要成分是铁锈,铁锈的成分复杂,主要成分是
搜集资料:
①不溶性碱
| 加热 |
②暖气片是由生铁铸成的;
③当地暖气用水为硬度较大的自来水;
④铁与铜都属于金属,有部分相似的化学性质.如:铜在潮湿的空气中可以形成铜绿[化学式为Cu2(OH)2CO3].
提出猜想:请根据上述任意一条资料分析,红褐色物质中还可能含有的物质是
设计实验:请设计一个实验来验证你的猜想(红褐色固体已干燥并研成粉末).
| 实验过程 | 预期的实验现象 |
| 答案 | 实验过程 | 预期的实验现象 |
| 答案1 | 取适量红褐色粉末装入试管中,加热. | 试管内壁有水珠出现 |
| 答案2 | ①取适量红褐色粉末装入试管中,加入过量的稀盐酸充分反应 ②过滤,将滤纸上的黑色固体烘干后放在石棉网(或燃烧匙中)用酒精灯灼烧. (③将涂有澄清石灰水的玻璃片放在固体上方) |
试管底部有黑色固体 黑色固体保持红热,并逐渐减少 (澄清石灰水变浑浊) |
| 答案3 | 检验碳酸钙: ①取适量红褐色粉末装入试管中,加入稀盐酸. ②将生成的气体通入澄清石灰水. |
有气泡产生 澄清石灰水变浑浊 |
| 检验氢氧化镁: 取适量红褐色粉末装入试管中,加热 |
试管内壁有水珠出现 | |
| 答案4 | ①取适量红褐色粉末装入试管中,加热. ②将产生的气体通入澄清石灰水. |
试管内壁有水珠出现 澄清石灰水变浑浊 |
答: