摘要:生成难溶解物不共存 Ca2+ .Ba2+ 与CO32- .SO42- , Fe3+.Mg2+ .Cu2+与OH―
网址:http://m.1010jiajiao.com/timu3_id_89036[举报]
(2013?浙江模拟)某兴趣小组探究以芒硝(Na2SO4?10H2O)和CaO为原料制备Na2CO3.
(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3.三元体系中反应的离子方程式为:
SO42-+Ca(OH)2+2H2O?CaSO4?2H2O+2OH-,△H=-15.6kJ?mol-1
该反应的平衡常数表达式K=
.
该反应在常温下不能自发进行,则可判断△S
(2)往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH=12.3[即c(OH-)为0.02mol?L-1],可使反应在常温下容易进行.反应后过滤,再向滤液中通CO2,进一步处理得到Na2CO3.
①在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是
②用平衡移动原理解释添加酸性物质的理由
以HA表示所添加的酸性物质,则总反应的离子方程式可写为
③添加的酸性物质须满足的条件(写出两点)是
④已知:某温度下,Ksp[Ca(OH)2]=5.2×10-6,Ksp(CaCaSO4)=1.3×10-4,设
的初始浓度为b mol?L-1,转化率为α,写出α与b的关系式
查看习题详情和答案>>
(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3.三元体系中反应的离子方程式为:
SO42-+Ca(OH)2+2H2O?CaSO4?2H2O+2OH-,△H=-15.6kJ?mol-1
该反应的平衡常数表达式K=
| c2(OH-) |
| c(SO42-) |
| c2(OH-) |
| c(SO42-) |
该反应在常温下不能自发进行,则可判断△S
<
<
0 (填“>”或“<”).(2)往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH=12.3[即c(OH-)为0.02mol?L-1],可使反应在常温下容易进行.反应后过滤,再向滤液中通CO2,进一步处理得到Na2CO3.
①在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是
碱性条件下CO2与Ca2+生成难溶物CaCO3
碱性条件下CO2与Ca2+生成难溶物CaCO3
;②用平衡移动原理解释添加酸性物质的理由
酸性物质与OH-反应,使平衡向生成CaSO4?2H2O的方向进行
酸性物质与OH-反应,使平衡向生成CaSO4?2H2O的方向进行
;以HA表示所添加的酸性物质,则总反应的离子方程式可写为
SO42-+Ca(OH)2+2HA?CaSO4?2H2O↓+2A-
SO42-+Ca(OH)2+2HA?CaSO4?2H2O↓+2A-
.③添加的酸性物质须满足的条件(写出两点)是
不与Ca2+生成难溶物
不与Ca2+生成难溶物
、酸性比碳酸弱
酸性比碳酸弱
.④已知:某温度下,Ksp[Ca(OH)2]=5.2×10-6,Ksp(CaCaSO4)=1.3×10-4,设
| SO | 2- 4 |
α=
| b-0.01 |
| b |
α=
.| b-0.01 |
| b |
 、
、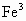 、
、 、
、
 、
、 、
、 、
、
 、
、 、
、 、
、
 、
、 、
、 、
、



