摘要:19.各地电视台的天气预报中都要预报城市的空气质量.预报中一般将城市空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)分为八个等级.目前测定空气中SO2含量时主要用一些氧化还原反应. 已知:SO2气体与酸性KMnO4溶液反应时.MnO被还原为Mn2+.SO2被氧化为SO.现有药品:KMnO4固体.颗粒吸附剂.品红试纸.pH试纸.1 mol/L的稀硫酸.蒸馏水等. 问题 你怎样测定空气中SO2的含量和可吸入颗粒的含量? 猜想 取一定体积的空气样品.然后让其通过酸性高锰酸钾溶液.根据MnO→Mn2+颜色变化.确定SO2的含量,同样让样品通过固体吸附剂.来测定可吸入颗粒的含量.首先配制酸性高锰酸钾溶液.称量吸附剂和盛放吸附剂仪器的总质量. 设计和实施方案 (1)配制200 mL 0.1 mol/L的酸性KMnO4溶液需用的仪器有 . .玻璃棒.胶头滴管.烧杯等.玻璃棒的作用是搅拌和 .注意在向容量瓶中加蒸馏水之前应加入 . (2)SO2与酸性KMnO4溶液反应的离子方程式为 .若气体的流速为a cm3/min.当t min时.200 mL 0.1 mol/L的酸性溶液恰好褪色.则空气中SO2的含量为 g/cm3. (3)空气中可吸入颗粒一般用固体吸附剂吸附.若要测定其含量.需要测出的数据有 . (4)空气中SO2的含量还可用检测管测定.其原理是:SO2与试剂KIO3发生作用.可能发生的反应有:①KIO3+SO2+H2O―→I2+H2SO4+KHSO4,②KIO3+SO2+H2O―→KI+H2SO4.设计检气管的原理是按照上述两个化学方程式中的方程式 设计的.理由是 . [解析] (1)配制酸性KMnO4(aq).要向溶液中加入一定量的稀硫酸. (2)V=at cm3.m(SO2)=0.2 L×0.1 mol/L××64 g/mol=3.2 g⇒SO2的含量为: g/cm3. (3)吸收前后固体吸附剂和盛放吸附剂仪器的总质量. [答案] 设计和实验方案 (1)200 mL容量瓶 托盘天平 引流 5 mL的1 mol/L的稀硫酸 (2)5SO2+2MnO+2H2O===2Mn2++5SO+4H+ (3)吸收前后固体吸附剂和盛放吸附剂仪器的总质量 (4)① 该反应前后溶液的颜色发生变化.能指示终点
网址:http://m.1010jiajiao.com/timu3_id_88926[举报]
各地电视台的天气预报中都要预报城市的空气质量。一般将城市空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)分为8个等级。目前,测定空气中SO2含量时主要是采用一些氧化还原法。已知:SO2气体与酸性KMnO4溶液反应时,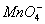 被还原成Mn2+,SO2被氧化成
被还原成Mn2+,SO2被氧化成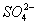 。
。
现有药品:0.1mol/L的酸性KMnO4溶液、颗粒吸附剂、品红试纸、pH试纸。
(1)配置250mL0.1mol/L的酸性KMnO4溶液需要用到的仪器有__________________、__________________、玻璃棒、胶头滴管、烧杯等,玻璃棒的作用是________________和________________。
(2)在测定SO2含量和可吸入颗粒的含量时,首先应测定________________,因为__________________________。
(3)写出SO2与酸性KMnO4溶液反应的离子方程式:_________________________________。
(4)若气体的流速为acm3/min,当tmin时,200mL0.1mol/L的酸性KMnO4溶液恰好完全褪色,则空气中的SO2的含量为___________g/cm3。
查看习题详情和答案>>