摘要:24.向盛有KI溶液的试管中加入少许CCl4后滴加氯水.CCl4层变成紫色.如果继续向试管中滴加氯水.振荡.CCl4层会逐渐变浅.最后变成无色. 完成下列填空: 1)写出并配平CCl4层由紫色变成无色的化学反应方程式: 2)整个过程中的还原剂是 . 3)把KI换成KBr.则CCl4层变为 色:继续滴加氯水.CCl4层的颜色没有变化.Cl2.HIO3.HBrO3氧化性由强到弱的顺序是 . 4)加碘盐中含碘量为20mg-50mg/kg.制取加碘盐(含KIO3的食盐)1000kg.若庄Kl与Cl2反应制KIO3.至少需要消耗Cl2 L. 答案:1)I2+5Cl2+6H2O→2HIO3+10HCl,2)KI.I2,3)红棕.HBrO3>Cl2>HIO3,4)10.58. 解析:此题考查氧化还原反应的配平.氧化剂和还原剂.氧化性强弱的判断.化学计算知识.分析反应从开始滴加少许氯水时.其将KI中的I元素氧化成碘单质,等CCl4层变紫色后.再滴加氯水时.其将碘单质进一步氧化成碘酸.1)根据氧化还原反应方程式的配平原则.分析反应中的化合价变化.I元素的化合价从0→+5.升高5价.Cl元素的化合价从0→-1.降低1价.综合得失电子守恒和质量守恒.可配平出:I2+5Cl2+6H2O→2HIO3+10HCl,2)分析整个过程中化合价升高的都是I元素.还原剂为:KI和I2,3)KI换成KBr时.得到的是溴单质.则其在CCl4中呈红棕色,继续滴加氯水时.颜色不变.可知氯水不能将溴单质氧化成HBrO3.故其氧化性强弱顺序为:HBrO3>Cl2>HIO3,4)综合写出反应方程式:KI+3Cl2+3H2O=KIO3+6HCl.根据化学方程式计算.按最小值计算时.1000kg加碘食盐中含碘20g.根据质量守恒.可知:换算成碘酸钾的质量为:33.70g.物质的量为:0.16mol.则需要消耗Cl2的体积为:(20g/127g.mol-1)×3×22.4L/mol=10.58L. 解法点拨:守恒定律是自然界最重要的基本定律.是化学科学的基础.在化学反应中.守恒包括原子守恒.电荷守恒.得失电子守恒等.任何化学反应在反应前后应遵守电荷或原子守恒.电荷守恒即反应前后阴阳离子所带电荷数必须相等,原子守恒.也就是反应前后各元素原子个数相等,得失电子守恒是指在氧化还原反应中.失电子数一定等于得电子数.即得失电子数目保持守恒.比如此题中我们就牢牢抓住了守恒.简化了计算过程.顺利解答. 31.白磷(P4)是磷的单质之一.易氧化.与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷.五卤化磷分子结构(以PCl5为例)如右图所示.该结构中氯原子有两种不同位置. 1)6.20g白磷在足量氧气中完全燃烧生成氧化物.反应所消耗的氧气在标准状况下的体积为 L. 上述燃烧产物溶于水配成50.0mL磷酸(H3PO4)溶液.该磷酸溶液的物质的量浓度为 mol·L-1. 2)含0.300mol H3PO4的水溶液滴加到含0.500mol Ca(OH)2的悬浮液中.反应恰好完全.生成l种难溶盐和16.2g H2O.该难溶盐的化学式可表示为 . 3)白磷和氯.溴反应.生成混合卤化磷(.且x为整数). 如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构).该混合卤化磷的相对分子质量为 . 4)磷腈化合物含有3种元素.且分子中原子总数小于20.0.10mol PCl5和0.10mol NH4Cl恰好完全反应.生成氯化氢和0.030mol磷腈化合物.推算磷腈化合物的相对分子质量. 答案:1)5.6,4.00,2)Ca5(PO4)3348或464. 解析:此题考查了元素化合物.化学计算知识.1)白磷燃烧生成五氧化二磷.白磷的相对分子质量为:128.则其6.20g的物质的量为:0.05mol.其完全燃烧消耗氧气0.25mol.标准状况下体积为5.6L,将这些白磷和水反应生成磷酸0.20mol.溶液体积为50mL.也就是0.05L.则磷酸溶液的物质的量浓度为4.00mol/L,2)根据该水溶液中含有溶质的物质的量和氢氧化钙悬浊液中溶质的物质的量.根据质量守恒.可知该物质中含有5个钙离子和3个磷酸根离子.结合电荷守恒.必还含有1个氢氧根离子.写作:Ca5(PO4)3根据题意x为整数.其可能为:PCl4Br.PCl3Br2.PCl2Br3.PClBr4四种.要是有三种不同结构的话.结合PCl5的结构.其可能为:PCl3Br2或PCl2Br3.则其相对分子质量可能为:297.5或342,4)根据题意和质量守恒定律.可求出化合物提供的Cl原子的物质的量为:0.1mol×5+0.1mol×1=0.6mol,由于磷腈化合物中只含有三种元素.故必须将其中的氢原子全部除去,两物质提供的H原子的物质的量为:0.1mol×4=0.4mol.则生成的氯化氢的物质的量为:0.1mol×4=0.4mol,则磷腈化合物中含有的Cl原子为:0.2mol.P原子为:0.1mol.N原子为:0.1mol.则该化合物的最简式为:PNCl2,假设其分子式为(PNCl2)x.由其含有的碳原子总数小于20.则知:4x<20.故x<5,假设x=4.其分子式为: P4N4Cl8.相对分子质量为464,假设x=3.其分子式为: P3N3Cl6.相对分子质量为:348,假设x=2.其分子式为:P2N2Cl4.相对分子质量<300 舍去.故其相对分子质量可能为:348或464.
网址:http://m.1010jiajiao.com/timu3_id_88476[举报]
向盛有KI溶液的试管中加适量溴水和四氯化碳,振荡后静置,可见到的现象是( )
A.上层为紫色液体,下层为无色液体 B.上层为无色液体,下层为紫色液体
C.均为紫色液体 D.上层为橙色液体,下层为紫色液体
查看习题详情和答案>>
向盛有KI溶液的试管中加适量溴水和四氯化碳,振荡后静置,可见到的现象是
- A.上层为紫色液体,下层为无色液体
- B.上层为无色液体,下层为紫色液体
- C.均为紫色液体
- D.上层为橙色液体,下层为紫色液体
|
向盛有KI溶液的试管中加适量溴水和四氯化碳,振荡后静置,可见到的现象是 | |
A. |
上层为紫色液体,下层为无色液体 |
B. |
上层为无色液体,下层为紫色液体 |
C. |
均为紫色液体 |
D. |
上层为橙色液体,下层为紫色液体 |
向盛有KI溶液的试管中加入一定量CCl4后,滴加少量氯水,振荡,CCl4层变成紫色,继续滴加氯水,振荡,CCl4层颜色会逐渐变浅直至无色.下列说法正确的是( )
| A、CCl4层显紫色是因为有I2生成 | B、CCl4层颜色变浅是因为I2变成I- | C、CCl4层显紫色是因为有Cl2生成 | D、CCl4层颜色变无色是因为I2的升华 |
 通过金属与盐溶液的置换反应可以比较金属还原性的强弱,通过非金属间的置换反应,也可以比较非金属氧化性的强弱.
通过金属与盐溶液的置换反应可以比较金属还原性的强弱,通过非金属间的置换反应,也可以比较非金属氧化性的强弱.实验一:说明氯的氧化性强于碘.
Ⅰ.向盛有KI溶液的试管中加入少许CCl4后,滴加新制氯水,振荡,CCl4层变成紫色.
用离子方程式表示CCl4层变紫色的原因
2I-+Cl2=I2+2Cl-
2I-+Cl2=I2+2Cl-
Ⅱ.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.
CCl4层最后变成无色的原理如下,完成并配平该反应:
5
5
Cl2
Cl2
+1
1
I2+6
6
H2O
H2O
→2
2
HIO3+10
10
HCl
HCl
Ⅲ.氯的非金属性比碘强,用原子结构解释原因:
同主族元素从上到下原子核外电子层数依次增多
同主族元素从上到下原子核外电子层数依次增多
,原子半径逐渐增大,得电子能力逐渐减弱.
实验二:说明氯元素的氧化性强于氮元素
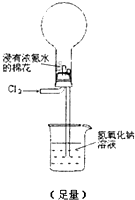
下面装置(烧瓶内已无空气)能实现Cl2置换N2的反应,请回答:
通入 Cl2 后:
Ⅰ.现象一:烧瓶中会出现白烟.白烟的成分是
NH4Cl
NH4Cl
.Ⅱ.现象二:形成喷泉,NaOH溶液进入烧瓶.烧瓶内压强减小的原因是
烧瓶内发生反应8NH3(g)+3Cl2(g)=N2(g)+6NH4Cl(s),气体大量减少,烧瓶内压强低于大气压
烧瓶内发生反应8NH3(g)+3Cl2(g)=N2(g)+6NH4Cl(s),气体大量减少,烧瓶内压强低于大气压
. 写出NaOH在烧瓶内发生反应的离子方程式NH4++OH-?NH3?H2O,Cl2+2OH-=Cl-+ClO-+H2O
NH4++OH-?NH3?H2O,Cl2+2OH-=Cl-+ClO-+H2O
Ⅲ.除上述现象外,能说明有N2产生的实验现象是
液体不能充满烧瓶
液体不能充满烧瓶
.