摘要:14.下列判断正确的是 A.测定硫酸铜晶体中结晶水含量时.灼烧至固体发黑.测定值小于理论值 B.相同条件下.2mol氢原子所具有的能量小于1mol氢分子所具有的能量 C.0.1 mol·L-1的碳酸钠溶液的pH大于0.1 mol·L-1的醋酸钠溶液的pH D.1L 1 mol·L-1的碳酸钠溶液吸收SO2的量大于1L mol·L-1硫化钠溶液吸收SO2的量 答案:C 解析:此题考查了实验操作.化学反应中的能量变化.溶液的pH.元素化合物等知识.测定硫酸铜晶体中结晶水含量时.灼烧至固体发黑.说明部分硫酸铜分解生成了氧化铜.测定值大于理论值.A错,氢原子转化为氢分子.形成化学键放出能量.说明2mol氢原子的能量大于1molH2.B错,碳酸的酸性弱于醋酸.故此相同浓度的碳酸钠溶液的pH大于醋酸钠溶液.C对,1L 1mol.L-1的溶液中含有溶质1mol.前者发生:Na2CO3+SO2+H2O=2NaHSO3+CO2↑,后者发生:2Na2S+5SO2+2H2O=4NaHSO3+3S↓,分析可知.很明显后者大于前者.D错. 易错警示:此题解答是的易错点有二:一是对化学键的形成断开和吸热放热的关系不清.要能够准确理解断键吸热成键放热,二是忽视亚硫酸的酸性强于氢硫酸.不能准确判断硫化钠中通入二氧化硫时要生成氢硫酸.造成氢硫酸和亚硫酸能发生氧化还原反应生成单质硫.
网址:http://m.1010jiajiao.com/timu3_id_88437[举报]
固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍。则下列判断正确的是
A.生成的气体C为单质,且B和C的摩尔质量比为1∶4
B.生成物C中A的质量分数为75%
C.生成物C中A、B的原子个数比为3∶1
D.反应前后气体分子数比为1∶4
在密闭容器中进行反应CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是
CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是
| A.0~5 min内,v(H2)=0.1 mol·(L·min)-1 |
| B.反应进行到12min时,CH4的转化率为25% |
| C.恒温下,缩小容器体积,平衡后H2浓度减小 |
| D.10 min时,改变的外界条件可能是升高温度 |
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应: 。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
| A.该条件下此反应的化学平衡常数约为0.91(L/mol)3 |
B.A的平均反应速率为0.3mol/(L s) s) |
| C.B的转化率为60% |
| D.若混合气体的密度不再改变时,该反应不一定达到平衡状态 |
 发生如下反应:3A(g)+B(g)
xC(g)+2D(g) 。2 min末该反应达到平衡,生成0.8molD,
发生如下反应:3A(g)+B(g)
xC(g)+2D(g) 。2 min末该反应达到平衡,生成0.8molD,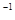 下列判断正确的是
下列判断正确的是