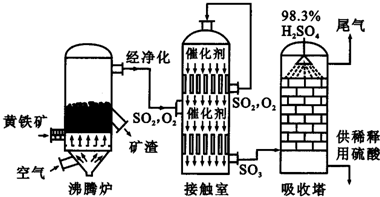
摘要: 以黄铁矿为原料生产硫酸的工艺流程图如下: (1)将燃烧黄铁矿的化学方程式补充完整 4 +11 (2)接触室中发生反应的化学方程式是 . (3)依据工艺流程图判断下列说法正确的是 . a. 为使黄铁矿充分燃烧.需将其粉碎 b. 过量空气能提高的转化率 c. 使用催化剂能提高的反应速率和转化率 d. 沸腾炉排出的矿渣可供炼铁 (4)每160g气体与化合放出260.6kJ的热量.该反应的热化学方程是 . (5)吸收塔排出的尾气先用氨水吸收.再用浓硫酸处理.得到较高浓度的和铵盐. ①既可作为生产硫酸的原料循环再利用.也可用于工业制溴过程中吸收潮湿空气中的.吸收的离子方程式是 . ② 为测定该铵盐中氮元素的质量分数.将不同质量的铵盐分别加入到50.00mL相同浓度的溶液中.沸水浴加热至气体全部逸出.该气体经干燥后用浓硫酸吸收完全.测定浓硫酸增加的质量. 部分测定结果, 铵盐质量为10.00g和20.00g 时.浓硫酸增加的质量相同,铵盐质量为30.00g时.浓硫酸增加的质量为0.68g,铵盐质量为40.00g时.浓硫酸的质量不变. 计算:该铵盐中氮元素的质量分数是 %, 若铵盐质量为15.00g. 浓硫酸增加的质量为 . 答案: (1)FeS2 (2) (3)a b d (4)SO3(g) + H2O(l) = H2SO4(l),ΔH=-130.3kJ/mol (5)①SO2 + Br2 + 2H2O = 4H+ + 2Br- + SO42- ②14.56 2.31g
网址:http://m.1010jiajiao.com/timu3_id_88360[举报]
 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入
接触室
接触室
(填设备名称)(2)催化氧化阶段反应2SO2(g)+O2(g)
| 催化剂 | △ |
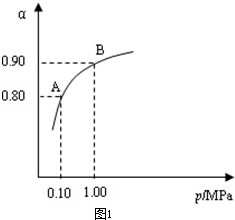
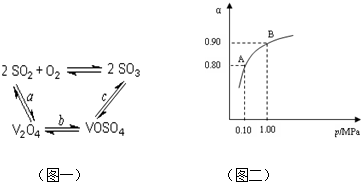
550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系
如图1所示.
理论上要提高SO2的转化率,反应的条件应是
低
低
温、高压(填“高”、“低”、或“常”),但通常情况下工业生产中采用常压的原因是使用常压SO2就可以达到较高的转化率
使用常压SO2就可以达到较高的转化率
.将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa.该反应的平衡常数等于
400L?mol-1
400L?mol-1
.(3)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,
回收率达91.7%以上.已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣.查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水.该工艺的流程如图.
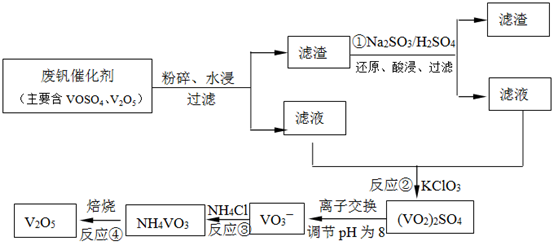
则:反应①②③④中属于氧化还原反应的是
①②
①②
(填数字序号),反应③的离子方程式为NH4++VO3-═NH4VO3↓
NH4++VO3-═NH4VO3↓
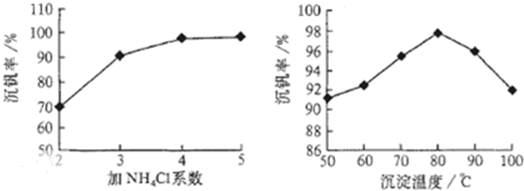
.该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图试建议控制氯化铵系数和温度:4
4
、80℃
80℃
. 
以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)将燃烧黄铁矿的化学方程式补充完整4
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是
(5)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得c(SO3)=0.040mol/L.则该条件下SO2的平衡转化率为
(6)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4.酸溶过程中需保持溶液足够酸性,其原因是
查看习题详情和答案>>

(1)将燃烧黄铁矿的化学方程式补充完整4
FeS2
FeS2
+11O2
| ||
(2)接触室中发生反应的化学方程式是
2SO2+O2
2SO3
| ||
| △ |
2SO2+O2
2SO3
.
| ||
| △ |
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)
abd
abd
.a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是
SO2+Br2+2H2O=4H++2Br-+SO42-
SO2+Br2+2H2O=4H++2Br-+SO42-
.(5)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得c(SO3)=0.040mol/L.则该条件下SO2的平衡转化率为
80%
80%
.(6)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4.酸溶过程中需保持溶液足够酸性,其原因是
抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+
抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+
.以黄铁矿为原料生产硫酸的工艺流程图如下:
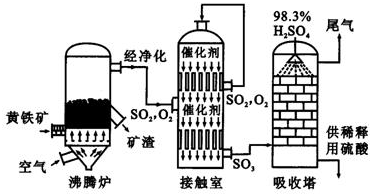
(1)将燃烧黄铁矿的化学方程式补充完整:4
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可制造水泥或制砖,含铁品位高的矿渣可炼铁
(4)每160g SO3气体与液态H2O化合放出260.6kJ的热量,该反应的热化学方程式是
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量.铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变.计算:该铵盐中氮元素的质量分数是
查看习题详情和答案>>

(1)将燃烧黄铁矿的化学方程式补充完整:4
FeS2
FeS2
+11O2
| ||
(2)接触室中发生反应的化学方程式是
2SO2+O2
2SO3
| ||
| △ |
2SO2+O2
2SO3
.
| ||
| △ |
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)
abd
abd
.a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可制造水泥或制砖,含铁品位高的矿渣可炼铁
(4)每160g SO3气体与液态H2O化合放出260.6kJ的热量,该反应的热化学方程式是
SO3(g)+H2O(l)=H2SO4(l);△H=-130.3kJ/mol
SO3(g)+H2O(l)=H2SO4(l);△H=-130.3kJ/mol
.(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是
SO2+Br2+2H2O=4H++2Br-+SO42-
SO2+Br2+2H2O=4H++2Br-+SO42-
.②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量.铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变.计算:该铵盐中氮元素的质量分数是
14.56
14.56
%;若铵盐质量为15.00g,浓硫酸增加的质量为2.31g
2.31g
.(计算结果保留两位小数)(2011?江山市模拟)以黄铁矿为原料生产硫酸的主要设备是沸腾炉、(炉气精制)、接触室和吸收塔等.
(1)请写出炉气制造即沸腾炉中黄铁矿燃烧的化学方程式
 (2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
(2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
A、精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如图1所示.在实际生产中,SO2催化氧化反应的条件选择常压、450℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是
B、接触室中2SO2(g)+O2(g)
2SO3(g),反应过程的能量变化如图2所示.
已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题: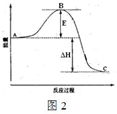
①图中C点表示
②反应达到平衡时,平衡常数表达式K=
,升高温度,K值
(3)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物.取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收.实验数据如下:
①该铵盐中(NH4)2SO3和NH4HSO3的物质的量之比为
②x的值为
查看习题详情和答案>>
(1)请写出炉气制造即沸腾炉中黄铁矿燃烧的化学方程式
4FeS2+11O2
2Fe2O3+4SO2
| ||
4FeS2+11O2
2Fe2O3+4SO2
.
| ||
 (2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
(2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.A、精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如图1所示.在实际生产中,SO2催化氧化反应的条件选择常压、450℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是
不选B点,因为压强越大对设备的投资大,消耗的动能大;SO2原料的转化率在1个大气压下的转化率已是97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用1个大气压
不选B点,因为压强越大对设备的投资大,消耗的动能大;SO2原料的转化率在1个大气压下的转化率已是97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用1个大气压
、不选择C点,因为温度越低,SO2转化率虽然更高,但催化剂的催化作用受影响,450℃时,催化剂的催化效率是高.故选择A点,不选C点.
不选择C点,因为温度越低,SO2转化率虽然更高,但催化剂的催化作用受影响,450℃时,催化剂的催化效率是高.故选择A点,不选C点.
.B、接触室中2SO2(g)+O2(g)
| ||
| △ |
已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:

①图中C点表示
生成物能量
生成物能量
,E的大小对该反应的反应热无
无
(填“有”或“无”) 影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点降低
降低
(填“升高”或“降低”).②反应达到平衡时,平衡常数表达式K=
| c2(SO3) |
| c2(SO2)c(O2) |
| c2(SO3) |
| c2(SO2)c(O2) |
减小
减小
(填“增大”、“减小”或“不变”);图中△H=-198
-198
kJ?mol-1.(3)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物.取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收.实验数据如下:
| 实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
| 第一次 | 1.570 | 0.340 |
| 第二次 | 3.140 | 0.680 |
| 第三次 | 4.710 | 0.510 |
| 第四次 | 6.280 | 0 |
2:1
2:1
.②x的值为
1.2
1.2
.工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥,其主要目的是
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图一).其中a、c二步的化学方程式可表示为:
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图二所示.则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa.该反应的平衡常数等于
查看习题详情和答案>>

(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥,其主要目的是
防止催化剂中毒
防止催化剂中毒
.(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图一).其中a、c二步的化学方程式可表示为:
SO2+V2O5?SO3+V2O4
SO2+V2O5?SO3+V2O4
、4VOSO4+O2?2V2O5+4SO3
4VOSO4+O2?2V2O5+4SO3
.(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图二所示.则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa.该反应的平衡常数等于
400 L?mol-1
400 L?mol-1
.A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是使用常压SO2就可以达到较高的转化率
使用常压SO2就可以达到较高的转化率
.