网址:http://m.1010jiajiao.com/timu3_id_87953[举报]
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:________;若XY2为共价化合物时,其结构式为:_________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103Pa),但在180℃就开始升华。据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是__________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题
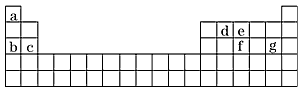
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式_______。
请用下列10种物质的序号填空:
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2,
其中由非极性键形成的非极性分子是________;由极性键形成的非极性分子是________;既有离子键又有非极性键的是________;既有离子键又有极性键的是________.
⑧NaF;⑨NH3;⑩I2。其中由非极性键形成的非极性分子是___________;由极性键形成的非极性分子
是_________;既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其化学式为____________;若XY2为共价化合物,则其结构式为____________。
(3)氯化铝的物理性质非常特殊,如氯化铝的熔点为190℃(2.02×103Pa),但在180℃就开始升华。据此判 断,氯化铝是____(填“共价”或“离子”)化合物。可以证明你的判断正确的实验依据是____________________。
(8分)(1)请用下列10种物质的序号填空:
①O2;②H2;③NH4NO3;④K2O2;⑤Ba(OH)2;⑥CH4;⑦CO2;⑧NaF;⑨NH3;⑩I2,其中由非极性键形成的非极性分子是________;由极性键形成的非极性分子是________;既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:________;若XY2为共价化合物,其结构式为:________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103 Pa),但在l80℃就开始升华。据此判断,氯化铝是____________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是________________________________________________________________________。
查看习题详情和答案>>
(8分)(1)请用下列10种物质的序号填空:
①O2;②H2;③NH4NO3;④K2O2;⑤Ba(OH)2;⑥CH4;⑦CO2;⑧NaF;⑨NH3;⑩I2,其中由非极性键形成的非极性分子是________;由极性键形成的非极性分子是________;既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:________;若XY2为共价化合物,其结构式为:________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103 Pa),但在l80℃就开始升华。据此判断,氯化铝是____________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是________________________________________________________________________。