摘要:实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙.大理石的主要杂质是氧化铁.以下是提纯大理石的实验步骤: (1)溶解大理石时.用硝酸而不用硫酸的原因是 (2)操作Ⅱ的目的是 .溶液A是 . (3)写出检验滤液中是否含铁离子的方法: . (4)写出加入碳酸铵所发生反应的离子方程式: . 写出滤液B的一种用途: . (5)CaO2中一般含CaO.试按下列提示完成CaO2含量分析的实验设计. 试剂:氢氧化钠标准溶液.盐酸标准溶液.酚酞 仪器:电子天平.锥形瓶.滴定管 实验步骤: ① ,②加入 ,③加入酚酞.用氢氧化钠标准溶液滴定. (6)若理论上滴定时耗用标准溶液20.00 mL恰好完全反应.实际操作中过量半滴.则相对误差为 . [解析] (1)H2SO4与CaCO3反应生成CaSO4.CaSO4微溶于水.附着在CaCO3的表面.阻止反应进一步发生. (2)溶液A应呈碱性且溶质为共价化合物.故溶液A是氨水.目的是除去Fe3+. (3)Fe3+能与KSCN溶液反应生成红色的Fe(SCN)3.用此原理来检验Fe3+的存在. (4)滤液B的主要成分是NH4NO3.可用于制造化肥. (5)首先称量固体的质量.再加入过量的盐酸标准溶液.过量的盐酸再用NaOH标准溶液滴定. (6)半滴溶液的体积为×= mL.则相对误差为×100%=0.1%. [答案] (1)硫酸钙微溶于水 (2)除去溶液中Fe3+ 氨水 (3)取少量滤液.向其中加入硫氰化钾溶液.溶液不变红色.说明滤液中不含Fe3+,或取少量滤液.向其中加入硫氰化钾溶液.溶液变红色.说明滤液中含Fe3+ (4)Ca2++CO===CaCO3↓ 作化肥 (5)称量 过量的标准盐酸 (6)0.1%
网址:http://m.1010jiajiao.com/timu3_id_87921[举报]
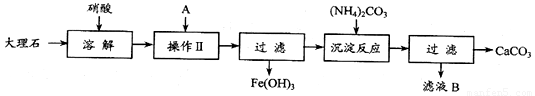
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙.大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
(1)溶解大理石时,用硝酸而不用硫酸的原因是
(2)操作Ⅱ的目的是
(3)写出加入碳酸铵所发生反应的离子方程式:
(4)所得滤液B是NH4NO3溶液,检验滤液中含有CO32-的方法是:
(5)写出滤液B的一种用途:
查看习题详情和答案>>

(1)溶解大理石时,用硝酸而不用硫酸的原因是
硫酸钙微溶于水
硫酸钙微溶于水
.(2)操作Ⅱ的目的是
除去溶液中的Fe3+
除去溶液中的Fe3+
.(3)写出加入碳酸铵所发生反应的离子方程式:
Ca2++CO32-=CaCO3↓
Ca2++CO32-=CaCO3↓
.(4)所得滤液B是NH4NO3溶液,检验滤液中含有CO32-的方法是:
取少量滤液,滴加盐酸产生使澄清石灰水变浑浊的气体
取少量滤液,滴加盐酸产生使澄清石灰水变浑浊的气体
.(5)写出滤液B的一种用途:
做化肥
做化肥
.(2009?上海)实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙.大理石的主要杂质是氧化铁.以下是提纯大理石的实验步骤:
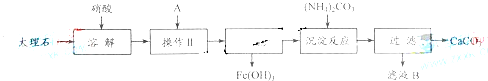
(1)溶解大理石时,用硝酸而不用硫酸的原因是
(2)操作Ⅱ的目的是
(3)写出检验滤液中是否含铁离子的方法:
(4)写出加入碳酸铵所发生反应的离子方程式:
(5)CaO2中一般含CaO.试按下列提示完成CaO2含量分析的实验设计.
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞仪器:电子天平、锥形瓶、滴定管
实验步骤:
①
(6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为
查看习题详情和答案>>

(1)溶解大理石时,用硝酸而不用硫酸的原因是
硫酸钙微溶于水
硫酸钙微溶于水
.(2)操作Ⅱ的目的是
除去溶液中Fe3+
除去溶液中Fe3+
,溶液A(溶质是共价化合物)是氨水
氨水
.(3)写出检验滤液中是否含铁离子的方法:
取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+;
或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+
或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+
取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+;
或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+
.或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+
(4)写出加入碳酸铵所发生反应的离子方程式:
Ca2++CO32-═CaCO3↓
Ca2++CO32-═CaCO3↓
写出滤液B的一种用途:作化肥
作化肥
.(5)CaO2中一般含CaO.试按下列提示完成CaO2含量分析的实验设计.
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞仪器:电子天平、锥形瓶、滴定管
实验步骤:
①
称量
称量
;②加入过量的标准盐酸
过量的标准盐酸
;③加入酚酞,用氢氧化钠标准溶液滴定.(6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为
0.1%
0.1%
.实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙.大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

(1)溶解大理石时,用硝酸而不同硫酸的原因是
(2)过滤时,某学生的操作如图所示,请指出图中的错误是.
(3)检验滤液中是否含铁,选用的试剂是
(4)写出加入碳酸铵所发生反应的离子方程式:
查看习题详情和答案>>

(1)溶解大理石时,用硝酸而不同硫酸的原因是
硫酸钙微溶于水
硫酸钙微溶于水
.
(2)过滤时,某学生的操作如图所示,请指出图中的错误是.
玻璃棒下端没有(或应该)靠在(三层)滤纸上、漏斗颈没有(或应该)靠在烧杯内壁
玻璃棒下端没有(或应该)靠在(三层)滤纸上、漏斗颈没有(或应该)靠在烧杯内壁
.(3)检验滤液中是否含铁,选用的试剂是
硫氰化钾溶液
硫氰化钾溶液
,现象溶液呈血红色
溶液呈血红色
,反应的离子方程式:Fe3++3SCN-=Fe(SCN)3
Fe3++3SCN-=Fe(SCN)3
.(4)写出加入碳酸铵所发生反应的离子方程式:
Ca2++CO32-=CaCO3↓
Ca2++CO32-=CaCO3↓
.![]() 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
![]()

![]() (1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________。
(1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________。
![]() (2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________。
(2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________。
![]() (3)写出检验滤液中是否含铁离子方程式:_____________________________________
(3)写出检验滤液中是否含铁离子方程式:_____________________________________
![]() ______________________________________________________________________。
______________________________________________________________________。
![]() (4)写出加入碳酸铵所发生反应的离子方程式:________________________________
(4)写出加入碳酸铵所发生反应的离子方程式:________________________________
![]() 写出滤液B的一种用途:_________________________
写出滤液B的一种用途:_________________________
![]() (5)
(5)![]() 中一般含
中一般含![]() 。试按下列提示完成
。试按下列提示完成![]() 含量分析的实验设计。
含量分析的实验设计。
![]() 试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞 仪器:电子天平、锥形瓶、滴定管
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞 仪器:电子天平、锥形瓶、滴定管
![]() 实验步骤:
实验步骤:
![]() ①_______;②加入_________________;③加入酚酞,用氢氧化钠标准溶液滴定。
①_______;②加入_________________;③加入酚酞,用氢氧化钠标准溶液滴定。
![]() (6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为______________
(6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为______________