网址:http://m.1010jiajiao.com/timu3_id_87919[举报]
将空气缓慢通过如下图所示装置后,在试管中收集到少量稀有气体。空气在通过a~d装置时,依次除去的气体是 ( )
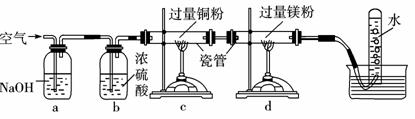
A.O2、N2、H2O、CO2
B.CO2、H2O、O2、N2
C.H2O、CO2、N2、O2
D.N2、O2、CO2、H2O
查看习题详情和答案>>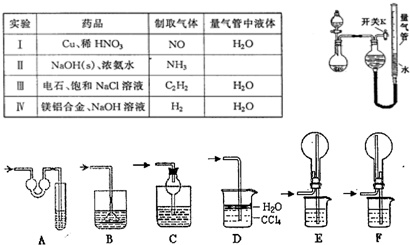
(1)实验过程中,使用分液漏斗滴加液体的操作是
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?
(3)实验Ⅲ烧瓶中发生反应的化学方程式是
(4)实验Ⅱ中量气管中的液体最好是
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有
(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,②
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |

文献记载:I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
II.FeSO4+NO?Fe(NO)SO4(棕色)△H<0.
III.NO2和NO都能被KMnO4氧化吸收.
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余. |
(1)滴入浓硝酸加热前没有明显现象的原因是
(2)检验是否生成-3价氮的化合物,应进行的实验操作是
(3)甲取少量B中溶液,加热,实验现象是
(4)乙认为甲得出A中有NO生成的证据不足.为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是
(5)证明A溶液中是否含有Fe2+和Fe3+,选择的药品是(填序号)
a.铁粉 b.溴水 c.鉄氰化钾溶液 d.硫氰化钾溶液.
(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)

由上述实验事实可知:
(1)①固体M中一定有的物质是______________(填化学式) 理由是_______________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________。
写出B装置中反应的离子方程式_______________________________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是_________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
a.M中有未反应的铁和硫 b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体 d.气体进入D装置前未用浓硫酸干燥
(B)某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯


(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是________________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
a.蒸馏时从70℃开始收集产品 b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看习题详情和答案>> 为测定Na3CO3与Na2SO3混合物中各组分的含量,取样品23.2g,用下图所示装置进行实验(铁架台、铁夹等仪器未在图中画出):
为测定Na3CO3与Na2SO3混合物中各组分的含量,取样品23.2g,用下图所示装置进行实验(铁架台、铁夹等仪器未在图中画出):(1)将仪器连接好以后,必须进行的第一步操作是:
(2)此实验还必须用到的最重要的仪器是
(3)若实验室中各有以下常用试剂:a.浓硫酸; b.品红溶液;c.酸性高锰酸钾溶液;d.饱和碳酸氢钠溶液;e.氢氧化钠溶液:f.无水硫酸铜;g.碱石灰;h.五氧化二磷;i.无水氯化钙.那么在B、D装置应该分别盛放的试剂是(填序号):B
已知装置c中装有品红溶液,但有人认为在c中若装品红溶液可能引起Na2S03含量的测量结果比实际值偏高,理由是
(4)实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中缓慢通入大量的空气.
这样做的目的是
(5)若装置E在实验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为